Zusammenfassung
Sekundäre Nierenerkrankungen sind Nierenschäden oder -funktionsstörungen, die durch systemische Erkrankungen oder externe Faktoren wie Medikamente, Intoxikationen
Zu den häufigsten Ursachen gehören Diabetes mellitus
Die Behandlung solcher sekundären Nierenerkrankungen konzentriert sich darauf, die zugrunde liegende systemische Erkrankung zu kontrollieren, um das Fortschreiten der Nierenschädigung zu verhindern. Eine frühzeitige Diagnose und Intervention sind entscheidend, um die Nierenfunktion zu erhalten.
Einteilung der sekundären Nierenerkrankungen
Im Folgenden werden ausgewählte sekundäre Nierenerkrankung nach dem primären intrarenalen Schädigungsort unterteilt. Die Beteiligung weiterer renaler Strukturen ist im Rahmen der einzelnen Erkrankungen jedoch ebenfalls möglich und wird in den jeweiligen Kapiteln beschrieben.
| Glomerulopathie | Gefäßerkrankungen mittelgroßer Gefäße | Tubulo-interstitielle Nephropathie (TIN) | |
|---|---|---|---|
 |  |
 | |
| Definition | Schädigung oder Entzündung der Glomeruli | Schädigung oder Entzündung der mittelgroßen Arterien, insbesondere der Aa. interlobulares | Akute oder chronische Entzündung der Tubuli und/oder des interstitiellen Bindegewebes des Nierenparenchyms |
| Erkrankungen |
|
|
|
Weitere sekundäre Nierenerkrankungen (Beispiele)
- Kardiorenale Syndrome (= wechselseitige Beeinflussung zwischen Herz- und Nierenerkrankungen)
- Urogenitaltuberkulose (= Manifestation verkäsender Tuberkulose-Granulome in den Nieren)
MerkeSekundäre Nierenerkrankungen sind häufig multifaktoriell bedingt und erfordern eine interdisziplinäre Behandlung zwischen Nephrologie und der Fachrichtung der Grunderkrankung.
Diabetische Nephropathie
DefinitionDie diabetische Nephropathie ist eine Folge der diabetischen Mikroangiopathie, die durch chronische Hyperglykämie bei Diabetes mellitus
verursacht wird und in der Niere insbesondere zur Schädigung der Glomeruli und renalen Arteriolen führt. Sie stellt die häufigste Ursache für terminales Nierenversagen weltweit dar.
Epidemiologie
- Betrifft etwa 20-40 % der Menschen mit Diabetes mellitus
, insbesondere bei Diabetes mellitus Typ 2 (DMT2) - Häufigste Ursache für eine chronische Nierenerkrankung
(CKD) (→ ursächlich für circa 30% der CKD) - Manifestation i.d.R. frühestens ab
≥ 5 Jahre nach Erstmanifestation eines Diabetes mellitus - Manifestationsalter abhängig vom Diabetes mellitus
Typ: - Diabetes mellitus Typ 2
(DMT2): insbesondere Ältere - Diabetes mellitus Typ 1
(DMT1): frühere Manifestation in jungen Jahren
- Diabetes mellitus Typ 2
MerkeDie diabetische Nephropathie betrifft bis zu 40 % der Diabetespatient:innen und ist mit circa 30% (DMT2 > DMT1) weltweit die häufigste Ursache für die chronische Nierenerkrankung
(CKD).
Ursache
- Langjähriger Diabetes mellitus
(≥ 5 Jahre), insbesondere bei schlechter Einstellung (HbA1c >7,5 %)
MerkeDas Risiko steigt mit der Dauer des Diabetes
!
InfoRisikofaktoren für die Progredienz einer diabetischen Nephropathie
- Insbesondere die langjährige Kombination von Diabetes mellitus
und arterieller Hypertonie - Schlecht eingestellter langjähriger Diabetes mellitus
(Hinweis: HbA1c >7,5 %, Diabetesdauer ≥ 5 Jahre) - Schlecht eingestellte langjährige arterielle Hypertonie
- Genetische Prädisposition (v.a. erstgradig Verwandte mit diabetischer Nephropathie)
- Albuminurie
- Dyslipidämie
- Tabakkonsum
- Übergewicht
AchtungDie diabetische und hypertensive Nephropathie beeinflussen sich wechselseitig negativ. Eine unzureichend kontrollierte arterielle Hypertonie
beschleunigt die Progression der diabetischen Nephropathie und umgekehrt. Daher sind frühzeitige regelmäßige Blutdruckkontrollen und eine adäquate medikamentöse Einstellung bei diabetischer Nephropathie essentiell zur Verringerung von Nierenschäden.
Pathophysiologie
Langjährige Hyperglykämie mit hoher intrazellulärer Glukosekonzentration bei genetisch prädisponierten Diabetes
- Bildung von Advanced Glycation Endproducts (AGEs; = nichtenzymatisch irreversibel glykierte Proteine)
- ➞ oxidativer Stress↑ mit Schädigung von Gefäßendothelzellen der renalen Arteriolen
und Glomeruli (= diabetische Mikroangiopathie) - → Schädigung der renalen Arteriolen
mit hyaliner Arteriolosklerose - → Schädigung der Glomeruli
mit - Ablösung der Podozytenfußfortsätze bis hin zu vollständigem Podozytenverlust ➞ Permeabilität für Proteine↑ ➞ glomeruläre Hyperfiltration
und Proteinurie - Diffuser oder nodulärer (= Kimmelstiel-Wilson
-) Glomerulosklerose
- Ablösung der Podozytenfußfortsätze bis hin zu vollständigem Podozytenverlust ➞ Permeabilität für Proteine↑ ➞ glomeruläre Hyperfiltration
- → Schädigung der renalen Arteriolen
- ➞ Akkumulation dieser AGE-Glykoproteine aufgrund von glykierungsbedingtem, verzögertem Abbau
- In der Glomerulären Basalmembran (GBM) → GBM Verdickung und veränderte Zusammensetzung mit reduzierter negativer Ladung der GBM → Permeabilität der GBM↑ → glomeruläre Hyperfiltration
und Proteinurie - Im Mesangium → mesangiale Matrixexpansion (= Proliferation der Mesangialzellen und Akkumulation mesangialer Matrixproteine)
- In der Glomerulären Basalmembran (GBM) → GBM Verdickung und veränderte Zusammensetzung mit reduzierter negativer Ladung der GBM → Permeabilität der GBM↑ → glomeruläre Hyperfiltration
- ➞ oxidativer Stress↑ mit Schädigung von Gefäßendothelzellen der renalen Arteriolen
- Lokale Synthese von profibrotischen und proinflammatorischen Mediatoren wie TGF-β
- → Induktion einer Entzündungsreaktion und eines bindegewebigen Umbaus des Nierenparenchyms → diffuse und/oder noduläre Glomerulosklerose, Tubulusatrophie und interstitielle Fibrose
- Lokale Synthese von vasoaktiven Mediatoren wie Angiotensin II durch Aktivierung des Renin-Angiotensin-Aldosteron
-Systems (RAAS) - → Vasokonstriktion der Vas efferens bei gleichzeitiger Vasodilatation der Vas afferens → intraglomerulärer hydrostatischer Druck↑ → glomerulärer Filtrationsdruck↑ und konsekutive Glomerulushypertrophie
- → 1. Glomeruläre Hyperfiltration
mit progredienter Albuminurie - → 2. Hypertonie-bedingte, progrediente Gefäßschäden → hyaline Arteriolosklerose und diffuse und/oder noduläre Glomerulosklerose (= diabetische Mikroangiopathie)
- → 1. Glomeruläre Hyperfiltration
- → Vasokonstriktion der Vas efferens bei gleichzeitiger Vasodilatation der Vas afferens → intraglomerulärer hydrostatischer Druck↑ → glomerulärer Filtrationsdruck↑ und konsekutive Glomerulushypertrophie
Folgen:
- Im Frühstadium: strukturelle Veränderungen der Niere mit vorerst glomerulärer Hyperfiltration
(→ insbesondere Albuminurie) und Glomerulushypertrophie - Im Endstadium: diffuse oder noduläre Glomerulosklerose, hyaline Arteriolosklerose, tubulo-interstitielle Fibrose und Atrophie → progredienter Verlust der Nierenfunktion
Stadieneinteilung
Stadien der diabetischen Nephropathie bei Diabetes mellitus Typ 1
| Stadium | Albuminurie [mg | eGFR [ml/min] | Renale Merkmale | Labor und Klinik | |
|---|---|---|---|---|---|
| Nierenschädigung mit normaler Nierenfunktion | |||||
| 1a | Mikroalbuminurie | 30-300 | >90 |
|
|
| 1b | Makroalbuminurie | >300 | >90 | ||
| Nierenschädigung mit chronischer Nierenerkrankung (CKD) | |||||
| 2 | Leichtgradige CKD | >300 | 60-89 |
|
|
| 3 | Mäßiggradige CKD | abnehmend | 30-59 | ||
| 4 | Hochgradige CKD | variabel | 15-29 | ||
| 5 | Terminales Nierenversagen | variabel | <15 |
|
|
MerkeDie Nieren schrumpfen bei diabetischer Nephropathie typischerweise erst sehr spät im Stadium 5.
Bei Diabetes mellitus Typ 2
Pathologie
- Makroskopische Merkmale:
- Frühstadium: vergrößerte Nieren aufgrund von glomerulärer Hyperfiltration
und Glomerulushypertrophie - Fortgeschrittenes Stadium: makroskopisches Bild einer chronischen Nierenerkrankung (CKD)→ zunehmende narbige Verkleinerungen (= Schrumpfniere) mit unregelmäßiger Oberfläche (knotenartig, vernarbt)
- Frühstadium: vergrößerte Nieren aufgrund von glomerulärer Hyperfiltration
AchtungIm Gegensatz zu anderen chronischen Nierenerkrankungen bleibt die Nierengröße bei diabetischer Nephropathie oft lange normal und nimmt im Stadium I passager sogar zu. Zu Schrumpfnieren kommt es häufig erst im Endstadium (= Stadium 5).
- Mikroskopische Merkmale:
- Verdickung der GBM und mesangiale Matrixexpansion
- Glomerulosklerose:
- Pathognomonische Kimmelstiel-Wilson
-Knoten (bei nodulärer Kimmelstiel-Wilson -Glomerulosklerose = Morbus Kimmelstiel-Wilson ): noduläre, azelluläre, eosinophile Kollagenablagerungen im Mesangium oder - Diffuse Glomerulosklerose
- Pathognomonische Kimmelstiel-Wilson
- Tubulusatrophie, Verdickung der Basalmembran der Tubuli und interstitielle Fibrose
- Hyaline Arteriolosklerose der afferenten und efferenten Arteriolen
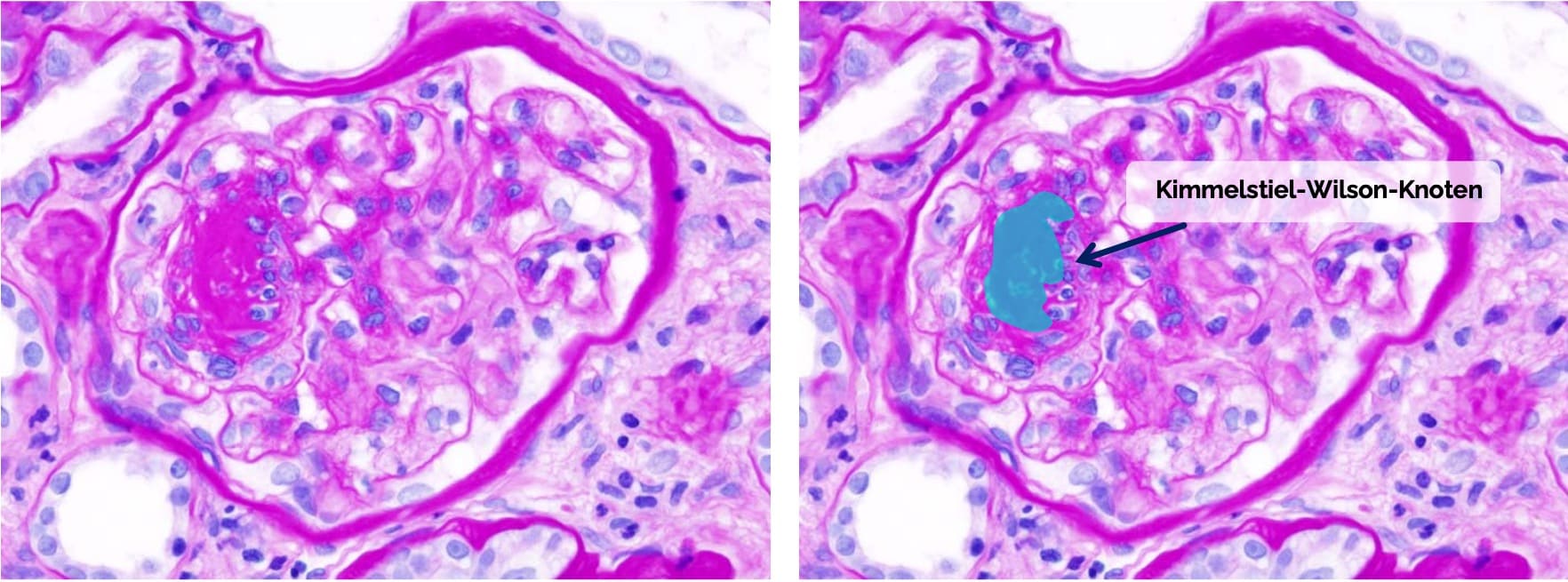
No machine-readable author provided. KGH assumed (based on copyright claims)., CC BY-SA 3.0 http://creativecommons.org/licenses/by-sa/3.0/, via Wikimedia Commons. Das identische Bild wurde rechts mit Markierungen, Beschriftungen und einem Pfeil versehen hinzugefügt.
Klinik
- Frühstadium: i.d.R. asymptomatisch, Mikroalbuminurie
(= Albuminurie Grad A2) als Erstsymptom im Diabetes -Screening - Im Verlauf: Makroalbuminurie
(= Albuminurie Grad 3) bis hin zu nephrotischem Syndrom, zunehmende arterielle Hypertonie - Spätstadium: Ödeme
(insbesondere an den Unterschenkeln), progrediente chronische Nierenerkrankung mit ggf. Urämie-Symptomen (z.B. Fatigue, Appetitlosigkeit, und Übelkeit) infolge der Akkumulation harnpflichtiger Substanzen
AchtungEine Mikroalbuminurie
kann mittels U-Stix nicht detektiert werden! Ein spezifischer Test wie der Micral-Test oder die Bestimmung des Albumin -Kreatinin -Ratio (ACR) im Urin ist zur Diagnose notwendig.
MerkeArterielle Hypertonie
kann sowohl ein Risikofaktor für die Progredienz als auch eine Folge der diabetischen Nephropathie sein!
Diagnostik
- Anamnese:
- Positive Familienanamnese für diabetische Nephropathie
- Langjährig bestehender, ggf. schlecht eingestellter Diabetes mellitus
, langjährig bestehende, ggf. schlecht eingestellte arterielle Hypertonie , Dyslipidämie - Tabakkonsum (Rauchen)
- Körperliche Untersuchung: engmaschige Blutdruckkontrolle (!)
- Labor:
- Serum
: - Blutzuckertagesprofil, HbA1c
- Nierenretentionsparameter↑ (v.a. Serum
-Kreatinin , Harnstoff ) - Geschätzte glomeruläre FIltrationsrate (eGFR) zunächst erhöht (= glomeruläre Hyperfiltration
) - dann progrediente Reduktion der eGFR (< 60 ml/min/1,73 m²) - Lipidstatus
- Blutbild
: ggf. renale Anämie als Komplikation der CKD
- Urin: Bestimmung der Albuminkonzentration im Serum
und der Albumin -Kreatinin -Ratio (ACR) im zweiten Morgenurin zur Feststellung einer persistierenden (!) Mikro- oder Makroalbuminurie in zwei aufeinanderfolgenden Proben im Abstand von 2-4 Wochen
- Serum
- Sonografie der Nieren
: im Frühstadium i.d.R. vergrößerte Nieren, erst im Endstadium verkleinerte Nieren - Nierenbiopsie
: selten durchgeführt, nur bei atypischen Befunden oder Verdacht auf eine andere zusätzliche Nierenerkrankung empfohlen
TippNephropathie-Screening bei Diabetes mellitus
= mindestens jährliches Screening auf Albuminurie (Albuminkonzentration im Serum
, Albumin -Kreatinin -Quotient) und Erhöhung des Serumkreatinins bzw. Reduktion der GFR , bei auffälligen Befunden häufiger (z.B. halbjährlich) Empfehlungen zum Beginn des Screenings:
- Diabetes mellitus
Typ 2: sofort ab Erstdiagnose - Diabetes mellitus
Typ 1: ab 5. Jahr nach Erstdiagnose
Therapie
- Nephroprotektion
: - Strikte Blutzuckerkontrolle: SGLT2-Inhibitoren (z. B. Empagliflozin) und GLP1-Analoga (z.B. Liraglutid), die nachgewiesene, nephroprotektive Effekte haben
- Ziel-HbA1c: < 7 %, individuelle Anpassung je nach Komorbiditäten und Hypoglykämierisiko
- Blutdruckkontrolle und Reduktion der Proteinurie
: - 1. Wahl ACE-Hemmer
(z. B. Ramipril) oder AT-1-Rezeptorblocker (z. B. Losartan) sind Mittel der 1. Wahl, da sie nachweislich die Proteinurie reduzieren und nephroprotektiv wirken - Zielblutdruck: abhängig vom Ausmaß der Albuminurie
- Albuminurie Grad 1 (<30 mg
/24 Std): < 140/90 mmHg - Albuminurie Grad 2 oder 3 (≥30 mg
/24 Std): < 130/80 mmHg
- Albuminurie Grad 1 (<30 mg
- Zielblutdruck: abhängig vom Ausmaß der Albuminurie
- 1. Wahl ACE-Hemmer
- Strikte Blutzuckerkontrolle: SGLT2-Inhibitoren (z. B. Empagliflozin) und GLP1-Analoga (z.B. Liraglutid), die nachgewiesene, nephroprotektive Effekte haben
Merke
Auch bei normotensiven Patient:innen werden ACE-Hemmer
oder AT-1-Rezeptorblocker eingesetzt, um die Proteinurie zu reduzieren! - Lipidmanagement: 1. Wahl Statine
(z. B. Atorvastatin) zur Senkung des LDL -Cholesterins und Reduktion des kardiovaskulären Risikos - Lebensstilveränderung
: - Diätetische Maßnahmen:
- Kochsalzrestriktion zur Reduktion der Hypertonie
- Proteinrestriktion: bei fortgeschrittener Nephropathie mit Makroalbuminurie
kann eine moderate Reduktion der Proteinaufnahme sinnvoll sein, um die Progression zu verlangsamen (Wirksamkeit umstritten!) - Diabetes
-orientierte Ernährung
- Kochsalzrestriktion zur Reduktion der Hypertonie
- Rauchstopp: verlangsamt das Fortschreiten der Erkrankung und reduziert das kardiovaskuläre Risiko
- Diätetische Maßnahmen:
- Vermeidung nephrotoxischer Substanzen
, z.B. Aminoglykoside
- Lipidmanagement: 1. Wahl Statine
- Nierenersatztherapie: Dialyse
oder Nierentransplantation bei terminalem Nierenversagen
MerkeEine frühzeitige und konsequente antihypertensive Therapie durch Blockade des RAAS mit ACE-Hemmern oder AT-1-Rezeptorblocker ist essenziell, um die Progression der diabetischen Nephropathie zu verlangsamen.
AchtungMedikamentöse Diabetestherapie bei stark eingeschränkter Nierenfunktion
Bei Patient:innen mit fortgeschrittener chronischer Nierenerkrankung (CKD) ist u.a.
- ab
einer eGFR <30 ml/min Metformin kontraindiziert - eine Dosisanpassung der oralen Antidiabetika
und ggf. Insulin aufgrund einer verminderten renalen Clearance notwendig (siehe Artikel → chronische Nierenerkrankung ) - die Kombination von Fibraten und Statinen aufgrund des Rhabdomyolyse-Risikos kontraindiziert
InfoPatient:innen mit diabetischer Nephropathie haben ein erhöhtes Risiko für kardiovaskuläre Ereignisse. Daher ist ein multidisziplinärer Behandlungsansatz mit der optimalen Einstellung von Blutglukose, Blutdruck, Lipiden und Therapie weiterer Begleiterkrankungen wichtig.
Hypertensive Nephropathie
DefinitionDie hypertensive Nephropathie ist eine Folge von degenerativer, Hypertonie-bedingter Arteriosklerose
und Arteriolosklerose der kleinen Nierengefäße, die zur Glomerulussklerose führt. Sie wird auch als benigne Nephrosklerose bezeichnet.
Epidemiologie
- Die genaue Inzidenz der hypertensiven Nephropathie ist nicht bekannt, da nur ein kleiner Prozentsatz der Fälle bioptisch abgeklärt wird
- Zweithäufigste Ursache für eine chronische Nierenerkrankung
(CKD ) (ursächlich für circa 20% der CKD ), oft kombiniertes Auftreten mit diabetischer Nephropathie
Ursache
- Langjährig bestehende, schlecht eingestellte arterielle Hypertonie
InfoRisikofaktoren für die Entstehung und/oder Progredienz einer hypertensiven Nephropathie
- Langjährig bestehende, schlecht eingestellte, ausgeprägte arterielle Hypertonie
- Langjährig bestehender, schlecht eingestellter Diabetes mellitus
(→Förderung der Progredienz) - Alter > 50 Jahre
- Männliches Geschlecht
- Genetische Disposition
- Afrikanische Abstammung (z. B. Afroamerikaner)
- Nikotinabusus
- Dyslipidämie
- Albuminurie
AchtungJe ausgeprägter die Blutdruckerhöhung, desto höher ist das individuelle Risiko für eine hypertensive Nephropathie!
Pathophysiologie
Chronische Druckbelastung der Gefäße durch arterielle Hypertonie
Pathologie
- Makroskopische Merkmale:
- Narbige Einziehungen der Oberfläche durch vaskuläre Sklerosierung sowie subkapsuläre Rindennarben, oft in Form von Schrumpfungsherden
- Verkleinerte, Schrumpfnieren
im fortgeschrittenen Stadium
- Mikroskopische Merkmale:
- Segmentale oder globale Glomerulosklerose: subendotheliale Ablagerung von hyalinem Material und Glomerulusvernarbung
- Hyaline Arteriolosklerose in afferenten und efferenten Arteriolen
mit Verdickung der Tunica media, Intimafibrose und zwiebelschalenartige Fibrose um Gefäße - Dilatation der Tubuli und Tubulusatrophie, Verdickung der Basalmembran der Tubuli
- Interstitielle Fibrose
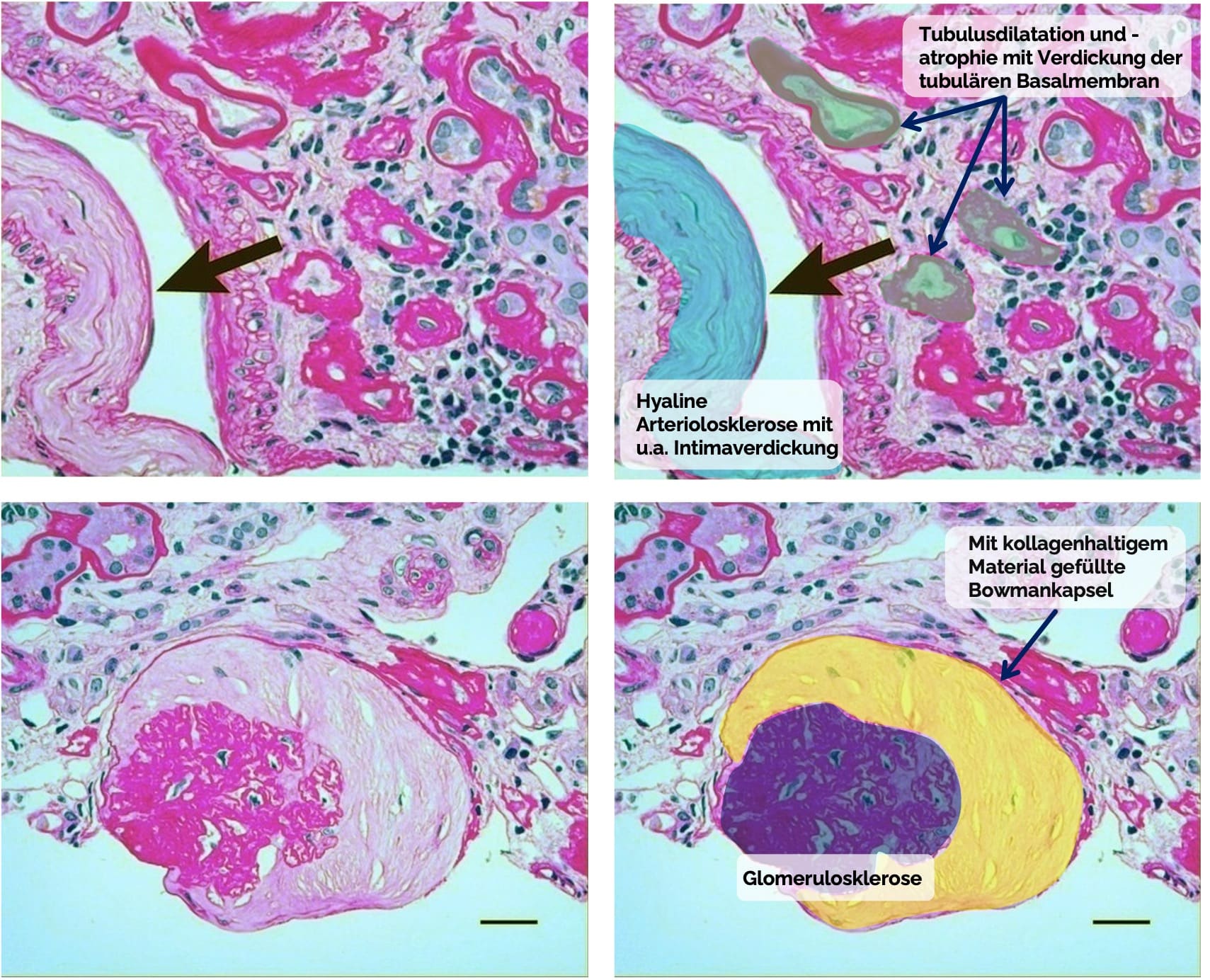
Bild oben: Rishi Sharma, Surineni Kamalakar, Ellen McCarthy, Timothy A. Fields, Kamal Gupta, Rajat Barua, Virginia Savin, CC BY 4.0 https://creativecommons.org/licenses/by/4.0, via Wikimedia Commons, Es handelt sich um einen Ausschnitt des Bildes. Das identische Bild wurde rechts mit Markierungen, Beschriftungen und Pfeilen versehen hinzugefügt.
Bild unten: Rishi Sharma, Surineni Kamalakar, Ellen McCarthy, Timothy A. Fields, Kamal Gupta, Rajat Barua, Virginia Savin, CC BY 4.0 https://creativecommons.org/licenses/by/4.0, via Wikimedia Commons. Das identische Bild wurde rechts mit Markierungen, Beschriftungen und einem Pfeil versehen hinzugefügt.
Klinik
- Frühstadium: i.d.R. asymptomatisch, Mikroalbuminurie
(= Albuminurie Grad A2) als Erstsymptom im Diabetes -Screening - Im Verlauf: Makroalbuminurie
(= Albuminurie Grad 3) bis hin zu nephrotischem Syndrom, zunehmende arterielle Hypertonie - Spätstadium: Ödeme
(insbesondere an den Unterschenkeln), progrediente chronische Nierenerkrankung (CKD ) mit ggf. Urämie-Symptomen (z.B. Fatigue, Appetitlosigkeit, und Übelkeit) infolge der Akkumulation harnpflichtiger Substanzen
AchtungBei einer malignen Nephrosklerose im Rahmen einer malignen Hypertonie
(= diastolischer Blutdruck >120 mmHg und fehlender nächtlicher Blutdruckabfall) entsteht neben einer Makroalbuminurie und rasch progredientem akutem Nierenversagen oft zusätzlich eine Hämaturie,
Stadieneinteilung
| Stadium | Merkmale |
|---|---|
| 1 | Mikroalbuminurie |
| 2 | Benigne hypertensive Nephrosklerose mit Makroalbuminurie |
| 3 | Schrumpfnieren |
Diagnostik
- Anamnese:
- Langjährig bestehende, ggf. schlecht eingestellte arterielle Hypertonie
- Langjährig bestehender, ggf. schlecht eingestellter Diabetes mellitus
als Risikofaktor für Progredienz der hypertensiven Nephropathie
- Langjährig bestehende, ggf. schlecht eingestellte arterielle Hypertonie
- Körperliche Untersuchung: Blutdruckmessung
zur Bestimmung des Grades der Hypertonie - Labor:
- Serum
: Nierenretentionsparameter↑, abnehmende GFR - Urin: Albuminurie
- Serum
- Sonografie der Nieren
: verkleinerte Nieren im fortgeschrittenen Stadium - Nierenbiopsie
: i.d.R. nicht erforderlich
MerkeEine persisitierende Mikroalbuminurie
ist ein starker Hinweis auf eine beginnende hypertensive Nephropathie und ein Prädiktor für zukünftige kardiovaskuläre Ereignisse. Die regelmäßige Bestimmung der Serum -Kreatininkonzentration, GFR und Albuminexkretion im Urin bei Patient:innen mit arterieller Hypertonie ist daher essenziell.
TippDie Diagnose einer hypertensiven Nephropathie erfolgt i.d.R. als
klinische Diagnose auf Basis von:
- Langjähriger arterieller Hypertonie
- Abnehmende GFR
, erhöhte Kreatininkonzentration im Serum und erhöhte Eiweißausscheidung im Urin - Anzeichen eines "hypertensiven Endorganschadens": GFR
< 60 ml/min/1,73 m²
Therapie
- Nephroprotektion
: - Konsequente Blutdrucksenkung: 1. Wahl: ACE-Hemmer
oder AT-1-Rezeptorblocker (→ siehe Artikel arterielle Hypertonie ) - Zielblutdruck: < 130/80 mmHg
- Bei begleitender Proteinurie
(>1 g/Tag): Senkung des Blutdrucks auf < 125/75 mmHg
- Bei zusätzlichem Diabetes mellitus
: strikte Blutzucker-Kontrolle - Lipidmanagement, Lebensstilveränderung
(siehe oben → Kapitel diabetischer Nephropathie) - Vermeidung nephrotoxischer Substanzen
- Konsequente Blutdrucksenkung: 1. Wahl: ACE-Hemmer
- Nierenersatztherapie: Dialyse
oder Nierentransplantation bei terminalem Nierenversagen
AchtungEine konsequente Blutdrucksenkung ist entscheidend, um das Risiko für eine fortschreitende Nierenschädigung und kardiovaskuläre Komplikationen zu reduzieren.
Renale Beteiligung bei systemischen Amyloidosen
Amyloidosen sind eine Gruppe von Erkrankungen, die durch die generalisierte, extrazelluläre Ablagerung von fibrillären Proteinen mit einer abnormalen β-Faltblattstruktur, sogenannte Amyloidfibrillen, in der Bindegewebsgrundsubstanz verschiedener Geweben und Organe gekennzeichnet sind. Diese Ablagerungen können die normale Funktion der betroffenen Organe beeinträchtigen und zu einer Vielzahl von Symptomen führen.
Es gibt verschiedene Typen von Amyloidosen, die basierend auf dem Ursprungsprotein des Amyloids klassifiziert werden, darunter:
| Amyloidosen-Typ | Ursprüngliches Protein | Grunderkrankung | Häufig betroffene Organe | |
|---|---|---|---|---|
AA-Amyloidose (häufigster Typ) |
 | Akute-Phaseproteine |
| Niere, Nebenniere |
| AL-Amyloidose | 
| Immunglobulinleichtketten (λ, κ) |
| Niere, Herz, peripheres Nervensystem, Gastrointestinaltrakt |
Bei AA- oder AL-Amyloidose kommt es häufig zu einer Nierenbeteiligung (= Nierenamyloidose), mit der Ablagerung von Amyloidfibrillen insbesondere in den Glomeruli
InfoGemeinsame Merkmale der Nierenamyloidosen
- Nierenbeteiligung: Ablagerung von Amyloid-Fibrillen insbesondere in den Glomeruli
und konsekutiv progredienter Glomerulopathie, seltener tubulär oder interstitiell - Klinik: nephrotisches Syndrom
- Diagnostik:
- Sonografie der Nieren
: vergrößerte, echodichte Nieren mit echoarmen Markpyramiden - Nierenbiopsie
: Goldstandard zur Diagnosesicherung
- Histologischer Nachweis von Amyloidfibrillen (= amorphes Material im Mesangium und in Kapillarschlingen) mittels Kongorotfärbung mit Doppelbrechung unter polarisiertem Licht
- Bei AL-Amyloidose: immunhistochemischer Nachweis von Leichtkettenproteinen
- Weitere Diagnostik zur Ursachenabklärung
- Therapie:
- Behandlung der Grunderkrankung
- AA-Amyloidose: Kontrolle der zugrunde liegenden chronischen Entzündung.
- AL-Amyloidose: Chemotherapie zur Kontrolle der Plasmazelldysfunktion (z. B. Bortezomib, Lenalidomid).
- Nephroprotektion
: insbesondere Blutdruckkontrolle und Vermeidung nephrotoxischer Medikamente - Nierentransplantation in ausgewählten Fällen bei terminalem Nierenversagen, jedoch eingeschränkte Erfolgsaussichten bei unkontrollierter Amyloidose
AchtungDie AL-Amyloidose hat eine schlechte Prognose mit einer durchschnittlichen Überlebenszeit von < 2 Jahre ohne adäquate Therapie!
TippBei unklarer Proteinurie
, hypertensiver Nierenerkrankung und vergrößerten Nieren sollte an eine Amyloidose gedacht und eine Nierenbiopsie erwogen werden.
Eine häufige Form der Nierenamyloidose stellt die Myelomniere bei multiplem Myelom dar.
Myelomniere
DefintionDie Myelomniere ist eine AL-Nierenamyloidose, die im Rahmen eines multiplen Myeloms auftritt. Sie gekennzeichnet durch die Akkumulation von monoklonalen Immunglobulinen (Paraprotein) oder deren Leichtketten (Bence-Jones-Protein) mit Ablagerung in intrarenalen Strukturen (→Leichtkettennephropathie) und/oder Obstruktion der Tubuluslumina durch die Bildung von Zylindern mit Tamm-Horsfall-Protein, sogenannte “Casts” (→ "Cast-Nephropathie").
Eine Progredienz zum akuten oder chronischen Nierenversagen ist häufig.
Epidemiologie
- Bei etwa 20-40 % der Patient:innen bereits bei Erstdiagnose des multiplem Myelom vorhanden
- Im Verlauf bei >50% der Patient:innen manifest
Ursache
- Multiples Myelom (= Plasmazelllymphom): niedrigmaligner, vom Knochenmark ausgehender Plasmazelltumor (B-Zell-Lymphom), der dysfunktionale, monoklonale Immunglobuline
oder Immunglobulinleichtketten (κ oder λ), produziert - Manifestation insbesondere mit >70 Jahren
- Weitere Merkmale:
- Osteoklastenaktivierung → Knochenosteolysen mit Freisetzung von Kalzium
→ Hyperkalzämie - Verdrängung der Hämatopoese
im Knochenmark → Panzytopenie - Mangel funktionaler Antikörper → Antikörper-Mangel-Syndrom
- Osteoklastenaktivierung → Knochenosteolysen mit Freisetzung von Kalzium
Pathophysiologie
Exzessive Bildung von monoklonalen Immunglobulinen (Paraprotein) bzw. κ- oder λ-Immunglobulinleichtketten (Bence-Jones-Protein) → hohe Leichtketten-Konzentration im Serum
→ Leichtkettennephropathie: Ablagerung von Leichtketten im Mesangium, der glomeruläre Basalmembran (GBM), der Basalmembran der Tubuli und Arteriolen
→ Cast-Nephropathie: hohe Leichtketten-Konzentration im Urin aufgrund von Überschreiten der tubulären Resorptionskapazität → Bildung unlöslicher Zylinder (Casts) mit Tamm-Horsfall Protein → Ablagerung in den distalen Tubuli → Tubulusobstruktion → Dilatation und Atrophie
AchtungBei circa 80 % der Patient:innen mit Leichtkettennephropathie findet eine Progredienz zur chronischen Nierenerkrankung (CKD
) statt! Die Cast-Nephropathie äußert sich klinisch meist in Form einer akuten Nierenschädigung
(AKI).
InfoRisikofaktoren für die Progredienz zur akuten Nierenschädigung
bei Cast-Nephropathie
- Hohe Konzentration von freien Leichtketten im Serum
- Exsikkose
: durch reduzierte Ausscheidung der Leichtketten bei unzureichender Hydratation - Hyperkalzämie
(Osteolyse-bedingt): durch begleitende Nephrokalzinose (siehe unten → Kapitel Nephrokalzinose) - Infektionen (Leukopenie
- und Antikörper-Mangel-bedingt)
Pathologie
- Makroskopische Merkmale:
- Oft vergrößerte Nieren aufgrund der Leichtketten-Ablagerung
- Im Verlauf Schrumpfnieren
bei CKD
- Mikroskopische Merkmale:
- Leichtkettennephropathie:
- Insbesondere mesangiale, glomeruläre, tubuläre Leichtketten-Ablagerungen
- Ggf. moderate interstitielle Fibrose und Entzündungsinfiltrat, Tubulusatrophie
- Ggf. kleinere, tubuläre Zylinder (Casts)
- Cast-Nephropathie:
- Insbesondere homogen-eosinophile, amorphe oder granuläre Zylinder
(Casts) im Tubuluslumen distaler Tubuli - Dilatation der Tubuli und Tubulusatrophie, interstitielles Entzündungsinfiltrat
- Ausgeprägte interstitielle Fibrose und Entzündungsinfiltrat (v.a. Lymphozyten und Plasmazellen)
- Ggf. begleitende Leichtketten-Ablagerungen im Nierenparenchym
- Insbesondere homogen-eosinophile, amorphe oder granuläre Zylinder
- Leichtkettennephropathie:
Klinik
- Leichtkettennephropathie: oft nephrotisches Syndrom
mit massiver Proteinurie und schäumendem Urin (Bence-Jones-Proteinurie ), häufig chronische Nierenerkrankung (CKD ) im Verlauf (siehe Artikel → akute Nierenschädigung ) - Cast-Nephropathie: oft akute Nierenschädigung
(AKI) als Erstsymptom, mit Oligurie und schwerer Azotämie (siehe Artikel → akute Nierenschädigung ) - Arterielle Hypertonie
Weitere Symptome durch multiples Myelom:
- Hyperkalzämie
-Zeichen, z.B. Übelkeit, Erbrechen, Verwirrtheit - Osteolyse-Zeichen, z.B. Knochenschmerzen, pathologische Frakturen
- Anämie
-Symptome, Infektneigung durch Antikörper-Mangel-Syndrom, Blutungsneigung
Merke
Merkspruch: CRAB → Calcium, Renal dysfunction, Anemia, Bone destruction
- Hyperkalzämie
Diagnostik
- Labor:
- Blut
: - Nierenretentionsparameter↑
- Hyperkalzämie
- Serum
-Elektrophorese : Nachweis einer monoklonalen Gammopathie mit M-Gradient (= pathologisch erhöhte γ-Fraktion durch massiven Anstieg von monoklonalen Immunglobulinen)
- Urin:
- Urin-Eiweißelektrophorese: Nachweis von Bence-Jones-Proteinen
- Urinsediment
: Casts (= Zylinder) aus Bence-Jones-Protein (= Leichtketten) und Tamm-Horsfall-Protein
- Blut
- Sonografie der Nieren
: oft vergrößerte Nieren, im Verlauf verkleinert bei CKD - Nierenbiopsie
: nicht zwingend erforderlich bei eindeutiger Klinik, Labor und Bildgebung eines multiplen Myeloms - Knochenmarkpunktion: Nachweis von Plasmazellnestern des multiplen Myeloms im Knochenmark
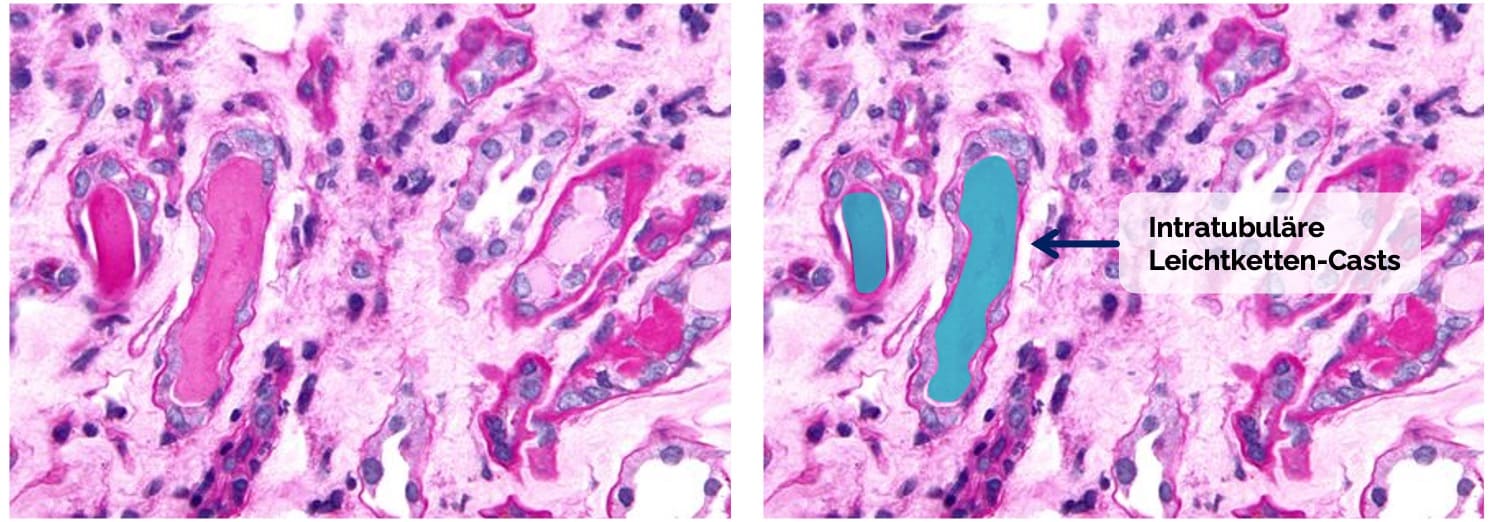
Nephron, CC BY-SA 3.0 https://creativecommons.org/licenses/by-sa/3.0, via Wikimedia Commons. Es handelt sich um einen Ausschnitt des Originalbilders. Das identische Bild wurde rechts mit Markierungen, Beschriftungen und einem Pfeil versehen hinzugefügt.
Therapie
- Frühzeitige Dialysetherapie bei akuter Nierenschädigung
oder refraktärer Hyperkalzämie - Rasche Chemotherapie des multiplen Myeloms: Proteasom-Inhibitoren (z. B. Bortezomib), Immunmodulatoren (z. B. Lenalidomid) und Glukokortikoide
zur Reduktion der Leichtkettenproduktion - Supportive Therapie:
- Hydrierung → Förderung der renalen Ausschwemmung der Leichtketten
- Therapie der Hyperkalzämie
: z.B. Bisphosphonate - Nephroprotektion
: z.B. Blutdruckeinstellung, Vermeidung nephrotoxischer Medikamente - Ggf. Plasmapherese: bei hoher Leichtketten-Konzentration zur raschen Reduktion der Serumspiegels
MerkeBei frühzeitiger, erfolgreicher Reduktion der Leichtketten mittels Chemotherapie und Hydrierung kann sich die Nierenfunktion stabilisieren und sogar teilweise erholen. Ein verzögerter Therapiebeginn führt meist zur chronischen Nierenschädigung mit dauerhafter Dialysepflicht.
Renale Beteiligung bei Vaskulitiden
Vaskulitiden sind eine Gruppe entzündlicher Erkrankungen der Blutgefäße (Arterien, Arteriolen
InfoGemeinsame Merkmale der Nierenbeteiligung bei Vaskulitiden
- Nierenbeteiligung:
- Kleingefäßvaskulitiden: nekrotisierende Glomerulonephritis
mit segmentalen Kapillarschlingennekrosen und ggf. Progredienz zur Rapid-progressive Glomerulonephritis (RPGN ) - Panarteriitis nodosa: häufig ischämische Schäden des Nierenparenchyms infolge einer Obliteration der mittelgroßen Gefäße durch entzündlich-fibrotische Veränderungen
- Klinik:
- Nephritisches Syndrom
- Systemische Symptome:
- Allgemeinsymptome: B-Symptomatik
(Fieber , Müdigkeit, ungewollter Gewichtsverlust) - Arterielle Hypertonie
- Hautveränderungen: bei Kleingefäßvaskulitiden insbesondere Petechien
oder palpable Purpura - Weitere Organbeteiligung: pulmonale Symptome (z.B. Hämoptysen bei GPA), Polyneuropathien, gastrointestinale Beschwerden
- Diagnostik:
- Autoantikörper-Diagnostik: z.T. ANCA (= antinukleäre zytoplasmatische Antikörper) positiv (ANCA-assoziierte Kleingefäßvaskulitiden)
- Sonografie der Nieren
: oft normal große oder leicht entzündlich-vergrößerte Nieren - Nierenbiopse: Goldstandard zur Diagnosesicherung
- Histologischer Nachweis von entzündlichen Infiltraten (v.a. Lymphozyten und Plasmazellen) in Gefäßwänden, Nekrosen
, Fibrosen, bei Kleingefäßvaskulitiden: Glomerulusschäden - Therapie:
- Behandlung der Grunderkrankung mittels immunsuppressiver Therapie
- Nephroprotektion
: insbesondere Blutdruckkontrolle und Vermeidung nephrotoxischer Medikamente - Bei fortgeschrittener Erkrankung mit Nierenversagen: Dialyse
- Ggf. Nierentransplantation, jedoch erst nach 6-monatiger Remission der Vaskulitis möglich (!)
AchtungEine rasche Nierenbiopsie
bei Verdacht auf eine Vaskulitis mit Nierenbeteiligung ist essenziell, um die Diagnose zu sichern und eine immunsuppressive Therapie frühzeitig einzuleiten!
Kleingefäßvaskulitiden
DefintionKleingefäßvaskulitiden sind entzündliche Erkrankungen der kleinen Gefäße (Arteriolen
, Kapillaren und Venolen ), deren häufigste und schwerwiegendste Komplikation die nekrotisierende Glomerulonephritis ist.
ANCA-assoziierte Vaskulitiden
- Formen und Hauptmerkmale:
| ANCA-Vaskulitis-Typ | Granulomatose mit Polyangiitis (GPA) (Synonym: Morbus Wegener) | Mikroskopische Polyangiitis (MPA) | Eosinophile Granulomatose mit Polyangiitis (EGPA) (Synonym: Churg-Strauss-Syndrom) |
 |  |  | |
| Beschreibung | Granulomatöse, nekrotisierende Vaskulitis kleiner bis mittelgroßer Gefäße mit charakteristischer Granulombildung | Nicht-granulomatöse, nekrotisierende Vaskulitis der kleinen Gefäße | Granulomatöse, nekrotisierende Vaskulitis kleiner bis mittelgroßer Gefäße mit Eosinophilie und Granulombildung |
| Typische ANCA | cANCA (= zytoplasmatische ANCA, v.a. Anti-Proteinase-3 (PR3-ANCA)) positiv | pANCA (= perinukleäre ANCA, v.a. Anti-Myeloperoxidase (MPO-ANCA)) positiv | pANCA > cANCA positiv, jedoch nicht immer nachweisbar |
| Nierenbeteiligung | Circa 50% v.a. pauci-immune, nekrotisierende Rapid-progressive Glomerulonephritis | Circa 80% v.a. pauci-immune, nekrotisierende Rapid-progressive Glomerulonephritis | Circa 50% v.a. mesangioproliferative Glomerulonephritis Nur selten Progredienz zur pauci-immune, nekrotisierenden RPGN |
| Weitere Manifestationen |
|
|
|
- Pathophysiologie: autoimmune Entzündungsreaktion, ausgelöst durch antineutrophile zytoplasmatische Antikörper (ANCA) gegen körpereigene Strukturen → nekrotisierende Vaskulitis der kleinen Gefäße → nekrotisierende pauci-Immune-Glomerulonephritis
bis hin zur pauci-immune Rapid-progressive Glomerulonephritis (= RPGN Typ III) (siehe Artikel → Glomerulonephritis ) - Gemeinsame renale Klinik:
- Nephritisches Syndrom
, progrediente Verschlechterung der Nierenfunktion - Renal-bedingte arterielle Hypertonie
- Bei RPGN
: rasche Entwicklung eines terminalen, dialysepflichtigen Nierenversagens
- Nephritisches Syndrom
- Diagnostik:
- Labor:
- Serum
: Entzündungsparameter↑, ANCA positiv, bei EGPA: Eosinophilie - Urin: nephritisches Sediment
- Serum
- Sonografie der Nieren
: normal große, ggf. entzündlich-vergrößerte Nieren - Nierenbiopsie
: zur Diagnosesicherung - Nachweis einer nekrotisierenden Glomerulonephritis
mit segmentalen Kapillarschlingennekrosen, ggf. mit extrakapillärer Proliferation (Halbmondbildung) ohne Immunkomplexablagerung (pauci-immune) bei RPGN
- Nachweis einer nekrotisierenden Glomerulonephritis
- Röntgen-Thorax
und CT : zur Beurteilung der Lungenbeteiligung sowie weiterer Organbeteiligungen
- Labor:
- Therapie bei RPGN
: - Induktionstherapie: hochdosiert Prednisolon
+ Cyclophosphamid oder Rituximab für 6 Monate - Bei Nierenversagen oder initialer Dialysepflichtigkeit: zusätzlich Plasmapherese zur raschen Reduktion der ANCA
- Erhaltungstherapie: Azathioprin
oder Methotrexat + ggf. niedrigdosiertes Prednisolon
- Induktionstherapie: hochdosiert Prednisolon
MerkeBei unklaren pulmonalen Rundherden oder Hämoptysen sollte differentialdiagnostisch immer an eine GPA gedacht werden!
Immunkomplex-Vaskulitiden
Purpura-Schönlein-Henoch (PSH; Synonym: IgA-Vaskulitis)
- Vaskulitis der kleinen Gefäße durch IgA-Immunkomplexablagerungen in den Gefäßwänden → Aktivierung des Komplementsystems → Gefäßdestruktion
- Insbesondere im Klein- und Schulkindalter (2-10 Jahre), häufig getriggert durch oberen Atemwegsinfekt
- Nierenbeteiligung:
- Bei Kindern in etwa ⅔ der Fälle, bei Erwachsenen nahezu immer vorhanden
- IgA-Nephritis
(= mesangioproliferative Glomerulonephritis vom IgA-Typ; Immunkomplex-Glomerulonephritis ) mit: - Episodischer Mikro-/Makrohämaturie
und geringer Proteinurie - Selten Entwicklung einer Rapid-progressive Glomerulonephritis
(RPGN ) Typ II (siehe Artikel → Glomerulonephritis )
- Episodischer Mikro-/Makrohämaturie
- Weitere Manifestationen:
- Haut: palpable Purpura und/oder Petechien
insbesondere an den Streckseiten der unteren Extremität und am Gesäß - Gastrointestinaltrakt: diffuser Kolikschmerz
, gastrointestinale Blutungen mit blutiger Diarrhö - Bewegungsapparat: nicht-erosive Arthritis und Arthralgien (v.a. Kniegelenke
und oberes Sprunggelenk )
- Haut: palpable Purpura und/oder Petechien
- Therapie: i.d.R. keine Immunsuppression notwendig, da meist selbstlimiterend
- Sehr selten bei schwerer Nierenbeteiligung: Glukokortikoide
+ ggf. Immunsuppressiva
- Sehr selten bei schwerer Nierenbeteiligung: Glukokortikoide
Kryoglobulinämische Vaskulitis
- Vaskulitis der kleinen Gefäße durch subendotheliale Ablagerung von Kryoglobulinen (= Kälteantikörper)
- 90% assoziiert mit Hepatitis C
- Nierenbeteiligung:
- Sehr selten, tritt ausschließlich bei schweren Verläufen auf
- Diffuse membranoproliferative Glomerulonephritis
(Immunkomplex-Glomerulonephritis ) mit nephrotischem oder nephritischem Syndrom
- Weitere Manifestationen:
- Haut: durch Kälte ausgelöste oder verstärkte palpable Purpura, Ulzera und/oder Nekrosen
insbesondere an den Akren - Bewegungsapparat: Arthralgien, Myalgien
- Nervensystem: Polyneuropathie, Mononeuritis multiplex
- Leber
/Milz: Hepatosplenomegalie
- Haut: durch Kälte ausgelöste oder verstärkte palpable Purpura, Ulzera und/oder Nekrosen
- Therapie:
- Plasmapherese (bei 37 °C) zur Entfernung von Kryoglobulinen + Glukokortikoide
+ Cyclophospamid oder Rituximab - Bei chronischer Hepatitis C: zusätzlich antivirale Therapie
- Plasmapherese (bei 37 °C) zur Entfernung von Kryoglobulinen + Glukokortikoide
Für weitere Informationen zu den einzelnen Formen der Glomerulonephritiden
Polyarteriitis nodosa
DefinitionDie Nierenbeteiligung bei Polyarteriitis nodosa (PAN; Synonym: Panarteriitis nodosa), eine Immunkomplex-Vaskulitis der mittelgroßen Arterien, ist gekennzeichnet durch eine chronisch-progrediente, transmurale nekrotisierende und obliterierende Entzündung insbesondere der Aa. interlobulares
und Aa. arcuatae der Nieren, mit konsekutiver Minderperfusion des Nierenparenchyms und ischämischen Parenchymschäden.
MerkeDie kleinen Gefäße (Arteriolen
, Kapillaren , Venolen ) inklusive der Glomeruli , sind nicht betroffen!
Epidemiologie
- Bei 70-90% der Patient:innen mit Polyarteriitis nodosa
Ursache
- Polyarteriitis nodosa: Immunkomplex-Vaskulitis der mittelgroßen Arterien
- Assoziation mit Hepatitis B und C (immunologische Reaktion gegen zirkulierende Virusbestandteile), Inzidenz durch Hepatitis-B-Impfung
rückläufig - Insbesondere Männer mittleren Alters (40–60 Jahre) betroffen
- Assoziation mit Hepatitis B und C (immunologische Reaktion gegen zirkulierende Virusbestandteile), Inzidenz durch Hepatitis-B-Impfung
Pathophysiologie
Transmurale, nekrotisierende Entzündung der Gefäßwände (Aa. interlobulares
→ fokale Ischämien und Infarkte des Nierenparenchyms → Abnahme der Nierenfunktion und/oder akutes Nierenversagen
→ Aktivierung des Renin-Angiotensin-Aldosteron
Pathologie
- Makroskopische Merkmale:
- Niereninfarkte, narbige, unregelmäßige Nierenareale
- Verdickte und sklerotische Arterien
- Mikroskopische Merkmale:
- Nekrotisierende Vaskulitis aller Wandschichten (= transmural) mit fibrinoider Nekrose
der Gefäßwände - Entzündliche Infiltrate aus neutrophilen Granulozyten und mononukleären Zellen
- Nekrotisierende Vaskulitis aller Wandschichten (= transmural) mit fibrinoider Nekrose
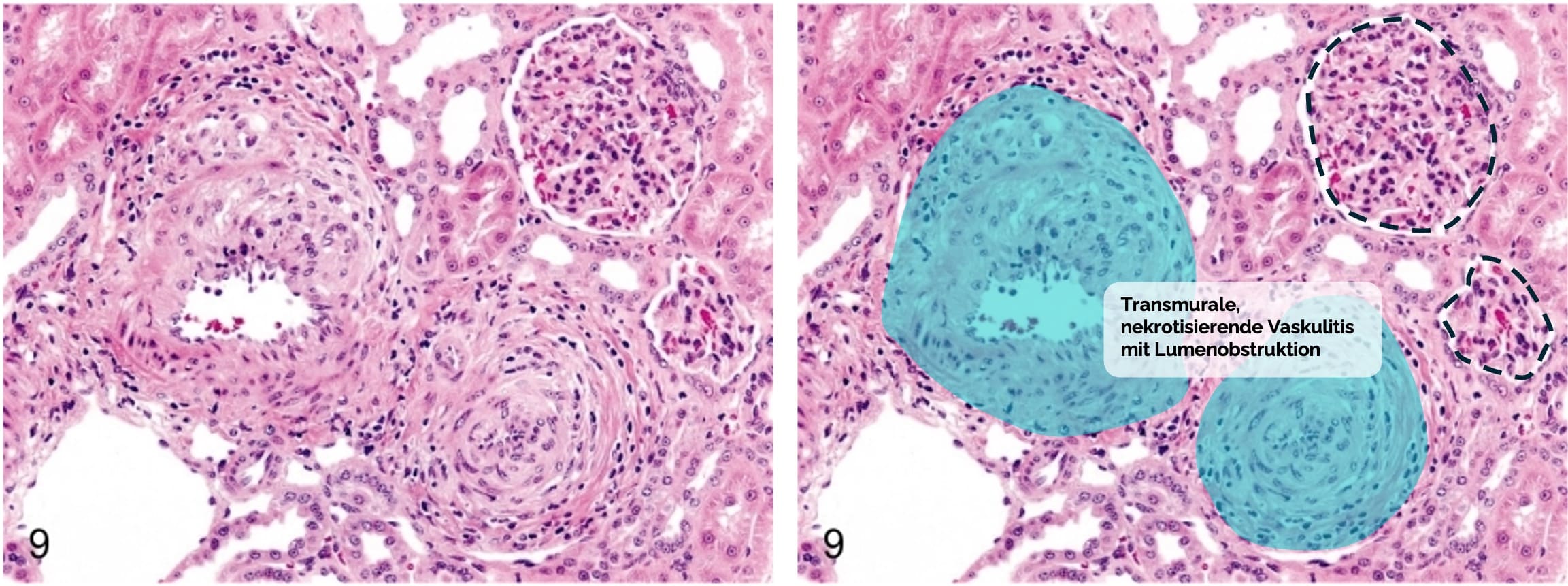
Figure out Sato J, Doi T, Kanno T, Wako Y, Tsuchitani M, Narama I. Histopathology of incidental findings in cynomolgus monkeys ( macaca fascicularis ) used in toxicity studies. J Toxicol Pathol. 2012 Mar;25(1):63-101. doi: 10.1293/tox.25.63. PMID: 22481861; PMCID: PMC3320159. Das identische Bild wurde rechts mit Markierung und Beschriftung versehen hinzugefügt.
Klinik
- Nephritisches Syndrom
, ggf. akutes Nierenversagen bei ausgedehnten Niereninfarkten - Weitere Manifestationen der Polyarteriitis nodosa:
- Allgemein: starke B-Symptomatik
- Haut: Livedo reticularis, schmerzhafte subkutane Knötchen entlang des Arterienverlaufs, Ulzera
- Bewegungsapparat: Arthralgien, Myalgien
- Nervensystem: Mononeuritis multiplex, Schlaganfall
, epileptische Anfälle - Gastrointestinaltrakt: postprandiale Angina abdominalis, gastrointestinale Blutungen
, Mesenterialinfarkte - Herz: circa 80% Koronaritis mit Myokardinfarkten bereits im jungen Alter
- Allgemein: starke B-Symptomatik
Diagnostik
- Körperliche Untersuchung: Blutdruckkontrolle
- Labor:
- Serum
: - Nierenretentionsparameter, Entzündungsparameter↑ (insbesondere BSG-Sturzsenkung!)
- Antikörper-Diagnostik: i.d.R. pANCA negativ
- Urin: Proteinurie
, Hämaturie, nephritisches Sediment
- Serum
- Sonografie der Nieren
: normal große, ggf. entzündlich-vergrößerte Nieren - Angiografie: Nachweis multipler Mikroaneurysmen, Gefäßstenosen, okkludierter Gefäße
- Nierenbiopsie
: Diagnosesicherung durch Nachweis der nekrotisierenden Vaskulitis
Therapie
- Remissionsinduktion: hochdosiert Glukokortikoide
+ Cyclophosphamid für 6-12 Monate - Bei Hepatitis B Assoziation: zusätzliche antivirale Therapie (z.B. Lamivudin)
- Erhaltungstherapie: Azathioprin
oder Methotrexat + niedrigdosiert Glukokortikoide
Renale Beteiligung bei Kollagenosen
Kollagenosen sind eine Gruppe von entzündlich-rheumatischen, systemischen Autoimmunerkrankungen, die das Bindegewebe betreffen und häufig mit einer signifikanten renalen Beteiligung assoziiert sind, insbesondere bei systemischem Lupus erythematodes (SLE) oder systemischer Sklerose (SSc; = Sklerodermie).
InfoGemeinsame Merkmale der Nierenbeteiligung bei Kollagenosen
- Nierenbeteiligung:
- SLE mit Lupusnephritis: Immunkomplex-Glomerulonephritis
mit glomerulären Ablagerungen von Immunkomplexen - SSc mit sklerodermatischer Nephropathie: fibrinoide Nekrosen
der Arterienwände, Intimafibrose und Tubulusatrophie - Klinik:
- Systemische Symptome: B-Symptomatik
(Fieber , Müdigkeit, ungewollter Gewichtsverlust), arterielle Hypertonie - Sekundäres Raynaud-Syndrom
- Symmetrische, i.d.R. nicht erosive Arthritiden, Athralgien, Myalgien
- Hautveränderungen (z. B. Sklerodermie bei systemischer Sklerose oder Schmetterlingserythem bei SLE)
- Weitere Organbeteiligung: z.B. an Herz, Lungen, Gastrointestinaltrakt, Nervensystem
- Diagnostik:
- Autoantikörper-Tests: Nachweis von
- ANA (= antinukleäre Antikörper)
- ENA (= extrahierbare nukleäre Antikörper): z.B. anti-dsDNA bei SLE, Anti-Scl-70 bei diffuser systemischer Sklerose
- Sonografie der Nieren
: normal große oder vergrößerte Nieren - Nierenbiopse: Goldstandard zur Diagnosesicherung
- Therapie:
- Behandlung der Grunderkrankung je nach Art der Kollagenose, z.B.:
- SLE mit Lupusnephritis: immunsuppressive Therapie
- SSc mit sklerodermatische Nephropathie: primär durch Blutdrucksenkung
- Nephroprotektion
: insbesondere Blutdruckkontrolle und Vermeidung nephrotoxischer Medikamente - Bei fortgeschrittener Erkrankung mit Nierenversagen: Dialyse
- Ggf. Nierentransplantation, jedoch erst bei stabiler Grunderkrankung
MerkeEin sekundäres Raynaud-Syndrom ist oft ein Frühsymptom systemischer Kollagenosen und sollte bei Verdacht auf Sklerodermie oder SLE abgeklärt werden.
Lupusnephritis
DefinitionDie Lupusnephritis ist eine der häufigsten und schwerwiegendsten Organmanifestationen des systemischen Lupus erythematodes (SLE). Sie ist gekennzeichnet durch eine Immunkomplex-Glomerulonephritis
, die von einer mesangialen, mesangioproliferativen, membranoproliferativen und membranösen Glomerulonephritis bis hin zu einer Rapid-progressive Glomerulonephritis (RPGN ) reichen kann.
Epidemiologie
- Bei 50-70 % der Patient:innen mit SLE im Verlauf
Ursache
- Systemischer Lupus erythematodes (SLE): eine Störung der Autoimmunität mit einer Hyperaktivität der B-Zellen bei simultan verminderter Aktivität der T-Zellen sowie Bildung organunspezifischer Autoantikörper, insbesondere Anti-dsDNA-Antikörper
- Häufig bei Frauen, insbesondere im gebärfähigen Alter (20-40 Jahre)
Pathophysiologie
Immunkomplexbildung aus Autoantikörpern (z.B. Anti-dsDNA-Antikörper) und Zielantigenen im Blut
Pathologie
Makroskopische Merkmale
- Zu Beginn: i.d.R. entzündlich-vergrößerte Nieren
- Bei chronischem Verlauf: verkleinerte, narbige Schrumpfnieren
Mikroskopische Merkmale
Klassifikation der Lupusnephritis nach ISN/RPS-Kriterien von 2003:
| Klasse | Bezeichnung und Häufigkeit | Histologische Merkmale |
|---|---|---|
| 1 | Minimale mesangiale Lupusnephritis (~1%) | Immunhistochemischer Nachweis mesangialer Immunkomplex-Ablagerungen ohne licht-/elektronenmikroskopisch erkennbare Veränderungen |
| 2 | Mesangial proliferative Lupusnephritis (~11%) | Granuläre mesangiale Immunkomplex-Ablagerung mit mesangialer Hyperzellularität und Expansion |
| 3 | Fokale Lupusnephritis (~36%) | <50% der Glomeruli Fokal-segmentale Glomerulonephritis |
| 4 | Diffuse Lupusnephritis (~39%) | >50% der Glomeruli Diffus |
| 5 | Membranöse Lupusnephritis (~14%) | Membranöse Glomerulonephritis |
| 6 | Fortgerschritten sklerosierte Lupusnephritis (~1%) | >90% der. Glomeruli |
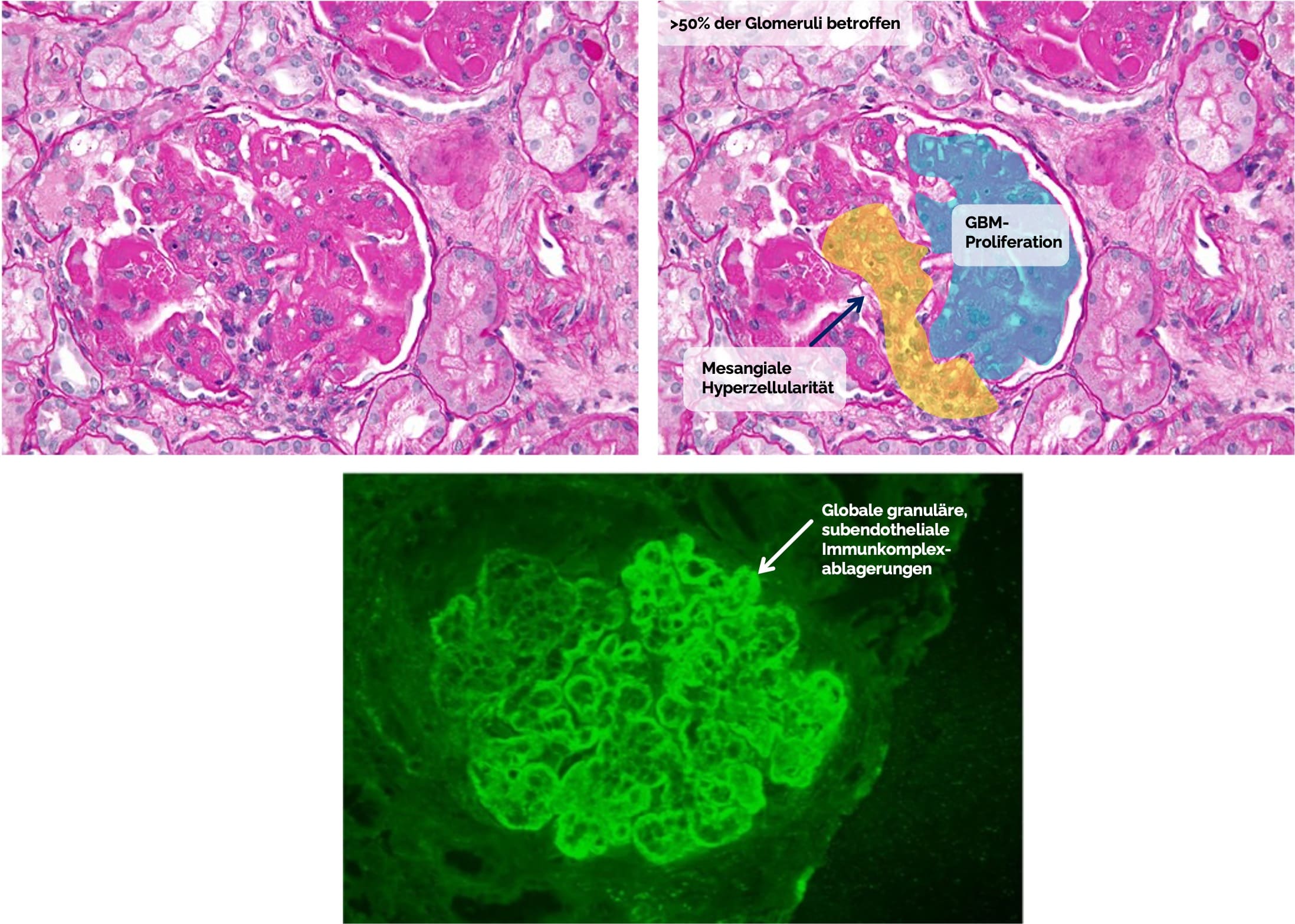
Bild 1 (oben): Nephron, CC BY-SA 3.0 <https://creativecommons.org/licenses/by-sa/3.0>, via Wikimedia Commons. Das identische Bild wurde rechts mit Markierungen, Beschriftungen und einem Pfeil versehen hinzugefügt.
Bild 2 (unten): Figure out Yong JL, Killingsworth MC, Lai K. Renal biopsy pathology in a cohort of patients from southwest Sydney with clinically diagnosed systemic lupus erythematosus. Int J Nephrol Renovasc Dis. 2013;6:15-26. doi: 10.2147/IJNRD.S34357. Epub 2013 Feb 13. PMID: 23431084; PMCID: PMC3575160. Das Bild wurde mit einem Pfeil und einer Beschriftung versehen.
Klinik
- Abhängig vom Lupusnephritis-Typ:
- Typ 1: meist asymptomatisch
- Typ 2: geringe Mikrohämaturie
und/oder milde Proteinurie (<1 g/Tag) - Typ 3: nephritisches Syndrom
, selten nephrotisches Syndrom - Typ 4: nephritisches oder nephrotisches Syndrom
, arterielle Hypertonie , Nierenfunktionseinschränkung - Typ 5: nephrotisches Syndrom
- Typ 6: progrediente Abnahme der Nierenfunktion bis hin zum terminalen Nierenversagen
- Weitere Manifestationen bei SLE:
- Allgemein: B-Symptomatik
- Haut: Schmetterlingserythem (= Lupus-Exanthem), diskoide Läsionen, Photosensitivität, Alopecia areata, Livedo racemosa, sekundäres Raynaud-Syndrom
- Bewegungsapparat: symmetrische, nicht-erosive Jacaud-Arthritis, Arthralgien, Myalgien
- Gastrointestinaltrakt: Ösophagitis
- Lunge
: Lungenfibrose, Pleuritis, Lupus-Pneumonitis, Pleuraerguss - Nervensystem: Polyneuropathie, Enzephalopathie
- Herz: Perikarditis
, Myokarditis , nicht-infektiöse Endokarditis (= Libman-Sacks-Endokarditis ), Perikarderguss - Antiphospholipid-Syndrom
: rezidivierende venöse und arterielle Thrombembolien
- Allgemein: B-Symptomatik
Diagnostik
- Körperliche Untersuchung: engmaschige Blutdruckkontrolle (!)
- Labor:
- Serum
: Nierenretentionsparameter↑ - Antikörper-Diagnostik: Nachweis von ANA (= antinukleäre Antikörper) + Anti-dsDNA-Antikörper (spezifisch für SLE), Anti-Sm-Antikörper
- Komplementfaktoren (C3, C4)↓
- Urin: Hämaturie, Proteinurie
, ggf. aktives nephritisches Sediment (Erythrozytenzylinder , Akanthozyten , dysmorphe Erythrozyten )
- Serum
- Nierenbiopsie
: Diagnosesicherung und Grundlage zur Klassifikation und Therapieplanung
TippBei Patient:innen mit SLE sind regelmäßige Kontrollen der Nierenfunktion und des Blutdrucks aufgrund der hohen Rate an Nierenbeteiligungen obligat!
Therapie
- Alle Typen:
- Nephroprotektion
: - Rasche, konsequente Blutdrucksenkung: 1. Wahl: ACE-Hemmer
oder AT-1-Rezeptorblocker - Vermeidung nephrotoxischer Substanzen
: engmaschige Kontrolle der Medikamenteneinnahme zur Vermeidung weiterer Nierenschäden
- Rasche, konsequente Blutdrucksenkung: 1. Wahl: ACE-Hemmer
- Kardioprotektion: Statine
zur Senkung des kardiovaskulären Risikos - Immunmodulation: Hydroxychloroquin
- Nephroprotektion
- Weitere Typ-abhängige Therapie:
- Typ 1: meist keine immunsuppressive Therapie indiziert
- Typ 2: alleinige Glukokortikoid
-Therapie - Typ 3 + 4: immer Immunsuppression
- Induktionstherapie: hochdosiert Prednisolon
+ Cyclophosphamid oder Mycofenolat mofetil (MMF ) für 3-6 Monate - Erhaltungstherapie: Azathioprin
oder MMF + ggf. niedrigdosiert Prednisolon - Bei Therapierefraktärität: Rituximab
, Cyclosporin A
- Induktionstherapie: hochdosiert Prednisolon
- Typ 5: symptomatische Therapie; Immunsuppression lediglich bei Proteinurie
> 3g/24 Std mit z.B. Prednisolon + Cyclophosphamid für 3-6 Monate - Typ 6: Nierenersatztherapie mittels Dialyse
oder Nierentransplantation, keine Immunsuppression mehr
MerkeBei frühzeitiger Diagnose und Therapie ist die Vermeidung einer Progredienz des Nierenschadens bis hin zur Erholung der Nierenfunktion möglich. Unbehandelt kann sich ein terminales Nierenversagen mit Dialysepflichtigkeit entwickeln.
TippRegelmäßige Kontrollen von Proteinurie
, Komplementfaktoren (C3, C4) und Anti-dsDNA-Titern sind wichtig zur Verlaufsbeurteilung der Lupus-Nephritis.
Sklerodermatische Nephropathie
DefintionDie sklerodermatische Nephropathie bezeichnet eine Nierenbeteiligung bei der diffusen systemischen Sklerose (dcSSc). Sie ist gekennzeichnet durch eine Bindegewebsvermehrungs-bedingte obliterierende, mikroangiopathische Schädigung der renalen Arteriolen
und kleinerer Arterien. Diese führt zu rezidivierenden renalen Mikroinfarkten und birgt das Risiko einer akuten renalen Krise mit schwerwiegender Hypertonie und akuter Nierenschädigung (AKI).
Epidemiologie
- Bei etwa 50 % der Patient:innen mit progressiver systemischer Sklerose (PSS) im Verlauf
- Eine akute renale Krise tritt bei 10–20 % der Betroffenen auf
Ursache
InfoRisikofaktoren für eine Nierenbeteiligung bei progressiver systemischer Sklerose
- Nachweis von RNA
-Polymerase-III-Antikörper - Diffuser Befall der Haut
- Hochdosierte Glukokortikoidtherapie
- Diffuse systemische Sklerose (dcSSc): eine Form der systemischen Sklerose (SSc) mit progredienter Sklerosierung von Haut und inneren Organen aufgrund einer überschießenden Fibroblastenaktivität und Kollagenvermehrung
MerkeDie in der Standardtherapie der systemischen Sklerose eingesetzten Glukokortikoide
sind mit einem erhöhten Risiko für die Entwicklung einer Nierenbeteiligung bzw. einer akuten renalen Krise verbunden.
Pathophysiologie
Fibrotische Veränderungen der Intima renaler Arteriolen
→ rezidivierende renale Mikroinfarkte → progrediente Abnahme der Nierenfunktion
→ Aktivierung des Renin-Angiotensin-Aldosteron
Folgen:
→ bleibende chronische Nierenschäden bis terminales Nierenversagen
Pathologie
Makroskopische Merkmale
- Oft narbig verkleinerte Nieren aufgrund multipler fibrotischen Veränderungen und Mikroinfarkte
Mikroskopische Merkmale
- Zwiebelschalenartige, fibrotische Verdickung der Intima von renalen Arteriolen
und kleinen Arterien bis in die Glomeruli (sog. Zwiebelschalenmuster) mit Obstruktion des Gefäßlumens - Vermehrung der mesangialen Matrix, leichte Glomerulosklerose
- Tubulusatrophie und interstitielle Fibrose
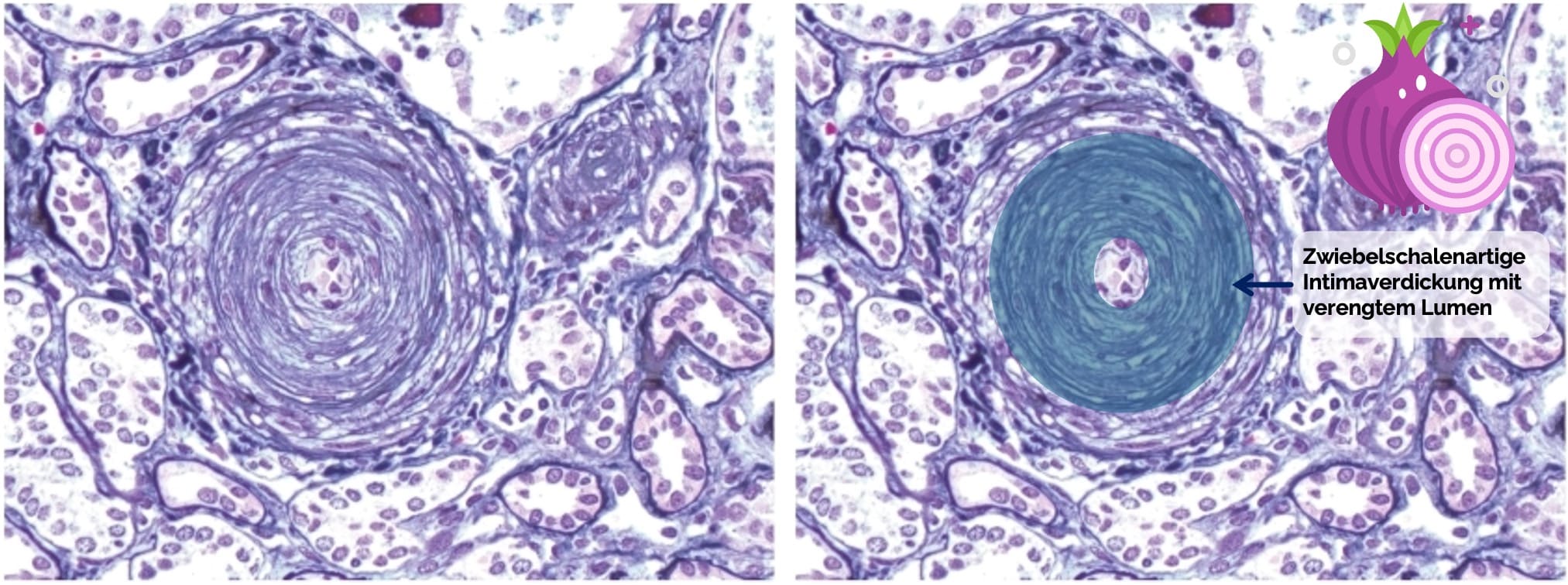
Figure out Batal I, Domsic RT, Medsger TA, Bastacky S. Scleroderma renal crisis: a pathology perspective. Int J Rheumatol. 2010;2010:543704. doi: 10.1155/2010/543704. Epub 2010 Jul 28. PMID: 20981312; PMCID: PMC2958499. Das identische Bild wurde rechts mit Markierung, Beschriftung und einem Pfeil versehen hinzugefügt.
Klinik
- Überwiegend milder Verlauf: geringe Proteinurie
, renal-bedingte arterielle Hypertonie - Akute renale Krise (10-20%):
- Akute Nierenschädigung
(AKI) mit rascher Verschlechterung der Nierenfunktion - Maligne Hypertonie
mit akutem Blutdruckanstieg > 150/85 mmHg - Oligurie
, Proteinurie , Hämaturie - Ggf. Retinopathie, Enzephalopathie, Lungenödeme
- Akute Nierenschädigung
- Weitere Manifestationen bei diffuser systemischer Sklerose:
- Sekundäres Raynaud-Syndrom (häufig als
Erstsymptom!) - Haut: Sklerosierung der Haut (Sklerodaktylie, Madonnenfinger, Tabaksbeutelmund mit Mikrostomie), stammbetonte Teleangiektasien
- Bewegungsapparat: Arthralgien, Myalgien
- Gastrointestinaltrakt: Ösophagusmotilitätsstörungen mit Dysphagie, Dünndarmatonie bis paralytischer Ileus
- Lunge
: basal betonte Lungenfibrose, pulmonale Hypertonie , Alveolitis - Herz: Myokardfibrose, Myokarditis
, Perikarditis - Speicheldrüsen: Sekundäres Sjörgen-Syndrom
- Sekundäres Raynaud-Syndrom (häufig als
Diagnostik
- Anamnese:
- Verlauf der systemischen Sklerose, v.a. diffuser Hautbefall
- Stattgehabte Hochdosis-Glukokortikoidtherapie in der Vergangenheit
- Körperliche Untersuchung: engmaschige Blutdruckkontrolle (!) zur Früherkennung der akuten renalen Krise
- Labor:
- Serum
: - Nierenretentionsparameter↑
- Autoantikörper-Tests: Nachweis insbesondere von ANA (= antinukleäre Antikörper) + Anti-Scl-70 (= Anti-Topoisomerase 1 Antikörper, spezifisch für diffuse SSc), ggf. RNA
-Polymerase-III-Antikörper (verbunden mit einem höheren Risiko für eine akute renale Krise) - Bei akuter renalen Krise: rascher Anstieg des Serum
-Kreatinins, Thrombozytopenie , hämolytische Anämie
- Urin: Proteinurie
und Hämaturie
- Serum
- Sonografie der Nieren
: verkleinerte, narbige Nieren bei chronischem Verlauf - Nierenbiopsie
: Diagnosesicherung durch Nachweis der typischen zwiebelschalenartigen Fibrose der Gefäßintima
Therapie
- Nephroprotektion
: - Rasche, konsequente Blutdrucksenkung: 1. Wahl: ACE-Hemmer
oder AT-1-Rezeptorblocker - Auch bei initial normotonen Patient:innen mit Verdacht auf akute renale Krise indiziert!
- Vermeidung nephrotoxischer Substanzen
: engmaschige Kontrolle der Medikamenteneinnahme zur Vermeidung weiterer Nierenschäden
- Rasche, konsequente Blutdrucksenkung: 1. Wahl: ACE-Hemmer
AchtungHochdosierte Glukokortikoide
sind kontraindiziert, da sie das Risiko für eine akute renale Krise erhöhen!
MerkeDie frühzeitige Behandlung der (progressiven) systemischen Sklerose und eine engmaschige Kontrolle des Blutdrucks sind entscheidend, um das Risiko einer renalen Krise zu minimieren!
Tritt eine renale Krise ein, ist die Prognose stark von der schnellen Erkennung und Behandlung der renalen Krise abhängig. Bei früher Behandlung kann sich die Nierenfunktion stabilisieren, eine vollständige Erholung ist jedoch selten.
AchtungCirca 20-50 % der Patient:innen entwickeln trotz antihypertensiver Therapie ein terminales Nierenversagen mit Notwendigkeit einer Dialysebehandlung
!
Nierensarkoidose
DefintionDie Nierensarkoidose ist eine seltene extrapulmonale Manifestation der Sarkoidose (= Morbus Boeck), einer granulomatösen Systemerkrankung mit Multiorganbefall. Während die Lunge
und die Hiluslymphknoten in über 90 % der Fälle betroffen sind, manifestiert sich die Sarkoidose in den Nieren meist als chronische, granulomatöse interstitielle Nephritis. Seltener treten Glomerulopathien oder andere renale Pathologien auf.
Epidemiologie
- Bei etwa 10-15 % der Patient:innen mit Sarkoidose
Ursache
- Sarkoidose: entzündliche Erkrankung unklarer Ätiologie, die durch die Bildung nicht-verkäsender Granulome gekennzeichnet ist
- Insbesondere junge Frauen im Alter zwischen 20 und 40 Jahren betroffen
Pathophysiologie
Entzündung mit Bildung von nicht-verkäsenden epitheloidzelligen Granulomen im interstitiellen Nierenparenchym → tubulo-interstitielle und ggf. glomeruläre Infiltration der Granulome
- → granulomatöse tubulo-interstitielle Nephritis mit Beeinträchtigung der Tubulusfunktion → selten Progredienz zu chronischer Nierenerkrankung (CKD
) bis hin zum terminalen Nierenversagen - → Konversion von 25-(OH) Vitamin D3
(Calcidiol; in Leber gebildet) in das biologisch aktive 1,25-(OH)2 Vitamin D3 (Calcitriol ) durch aktivierte Makrophagen in den Granulomen → intestinale Resorption von Calcium ↑ → Hyperkalzämie → Hyperkalzurie → Nephrokalzinose (→ siehe unten Kapitel Nephrokalzinose) und Urolithiasis (v.a. Calciumoxalatsteine )
MerkeEine häufige Manifestation der Nierensarkoidose ist die Hyperkalzämie
, die durch die Aktivierung von Vitamin D in seine aktive Form durch aktivierte Makrophagen der Granulome verursacht wird.
Pathologie
- Makroskopische Merkmale:
- Oft vergrößerte Nieren
- Ggf. sichtbare Granulome: feste, gelbliche Knötchen im Nierenparenchym
- Mikroskopische Merkmale:
- Nicht-verkäsende (= ohne zentrale Nekrose
) Granulome im Interstitium aus Epitheloidzellen, Langhans-Riesenzellen, einem schmalen Lymphozytensaum und aktivierten Makrophagen - Ggf. Tubulusatrophie und interstitieller Fibrose durch Granulominfiltration
- Selten glomeruläre Beteiligung mit segmentaler Glomerulosklerose
- Nicht-verkäsende (= ohne zentrale Nekrose
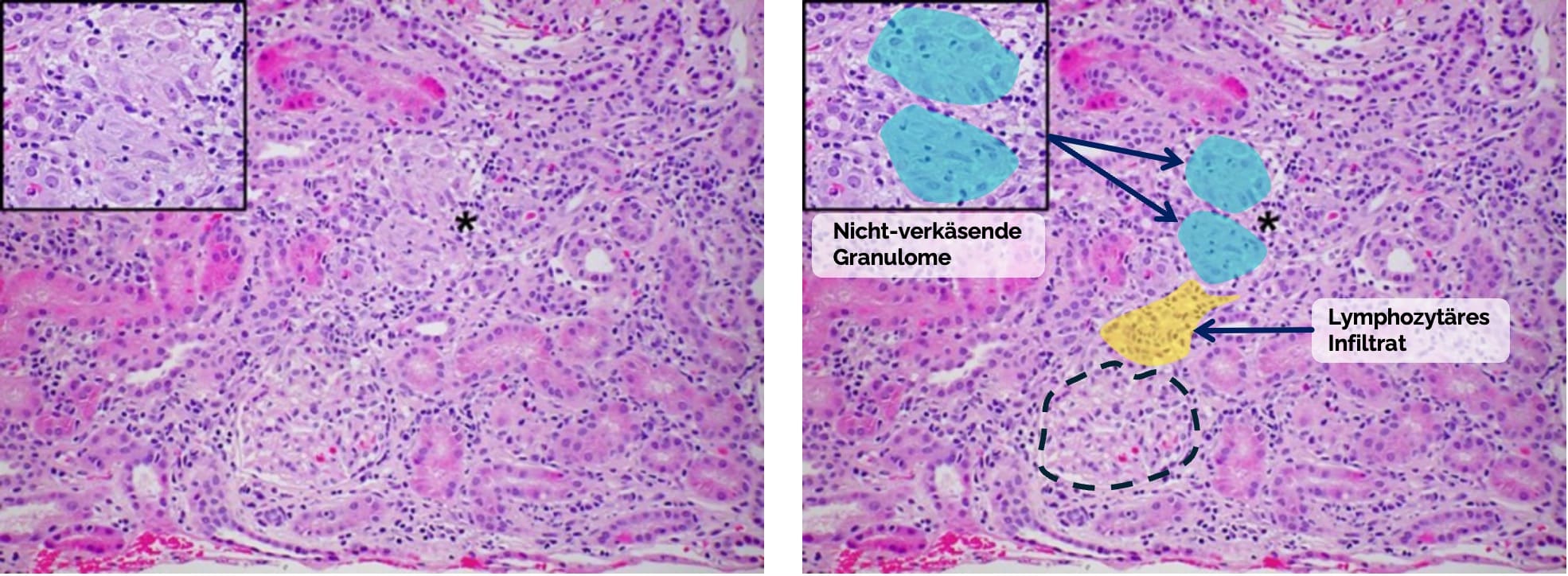
Figure out Pepple KL, Lam DL, Finn LS, Van Gelder R. Urinary β2-Microglobulin Testing in Pediatric Uveitis: A Case Report of a 9-Year-Old Boy with Renal and Ocular Sarcoidosis. Case Rep Ophthalmol. 2015 Mar 20;6(1):101-5. doi: 10.1159/000381092. PMID: 25873895; PMCID: PMC4395824. Das identische Bild wurde rechts mit Markierungen, Beschriftungen und Pfeilen versehen hinzugefügt.
Klinik
- Symptome der Tubulusschädigung und Nephrokalzinose: Polyurie
, Polydipsie, Hyperkalzämie -Zeichen wie Übelkeit, Erbrechen oder Muskelschwäche (→ siehe unten Kapitel Nephrokalzinose) - Ggf. Symptome einer begleitenden Urolithiasis
: Flankenschmerzen, Hämaturie - In fortgeschrittenen Fällen: Symptome einer chronischen Nierenerkrankung (CKD
) bis hin zum terminalen Nierenversagen (→ siehe Artikel chronische Nierenerkrankung )
Diagnostik
- Labor:
- Serum
: - Nierenretentionsparameter↑
- Hyperkalzämie
, 1,25-(OH)2 Vitamin D3 ↑ - Sarkoidosemarker: BSG↑, ACE↑, polyklonale Hypergammaglobulinämie
- Urin: Hyperkalzurie, ggf. geringe tubuläre Proteinurie
, Leukozyturie
- Serum
- Sonografie der Nieren
: oft vergrößerte Nieren, Zeichen einer Nephrokalzinose oder Nephrolithiasis - Röntgen-Thorax
: ggf. Zeichen einer pulmonalen Sarkoidose (bihiläre Lymphadenopathie , retikulonoduläre Zeichnungsvermehrung, Lungenfibrose) - Nierenbiopsie
: Diagnosesicherung durch Nachweis von nicht-verkäsenden epitheloidzelligen Granulomen im Interstitium
Therapie
- Indikation zur Therapie:
- Hyperkalzämie
(symptomatisch oder persistierend) - Progrediente Nierenfunktionseinschränkung
- Ausgeprägte Nephrokalzinose oder tubuläre Dysfunktion
- Hyperkalzämie
- Therapieschema:
- 1. Glukokortikoide
(GCS ) z.B. Prednisolon i.v. → Reduktion der Granulombildung und interstitiellen Entzündungsreaktion, Senkung des Serumkalzium-Spiegels - Zusätzlich ggf. Bisphosphonate
zur Hemmung der Kalziumfreisetzung
- Zusätzlich ggf. Bisphosphonate
- 2. Bei Versagen der GCS
-Monotherapie: reduzierte Glukokortikoid -Dosis + zusätzliches Immunsuppressivum z.B. Azathioprin oder Methotrexat , bei Therapieversagen: z.B. Cyclophosphamid oder TNFα-Inhibitoren
- 1. Glukokortikoide
InfoGlukokortikoide
senken den Serumkalzium-Spiegel durch eine Verringerung der intestinalen Kalziumresorption und Hemmung der Aktivierung von Vitamin D durch die aktivierten Makrophagen der Granulome.
TippRegelmäßige Kontrolle von Serumkalzium, Kreatinin
und ACE-Wert ist entscheidend zur Beurteilung der Krankheitsaktivität und Nierenfunktion bei Sarkoidose.
Uratnephropathie
DefinitionDie Uratnephropathie ist eine Manifestation der akuten oder chronischen Hyperurikämie (= Harnsäurespiegel ≥ 6,5 mg
/dl) in den Nieren, gekennzeichnet durch die Ausfällung von Uratkristallen (= Harnsäurekristallen) im Tubulussystem und/oder Nierenparenchym. Unterschieden werden eine akute Uratnephropathie mit einer akuten intratubulären Ausfällung großer Mengen an Uratkristallen und Verstopfung des Tubuluslumens sowie eine chronische Uratnephropathie mit der tubulo-interstitiellen Ablagerung von Uratkristallen und der Entwicklung einer chronischen interstitiellen Nephritis.
Epidemiologie
- Akute Uratnephropathie: insbesondere im Rahmen eines Tumorlyse
-Syndroms bei Patient:innen mit hämatologischen Neoplasien - Chronische Uratnephropathie: selten, aufgrund moderner Therapien zur Harnsäuresenkung bei chronischer Gicht
Ursache
Akute oder chronische Hyperurikämie (= Harnsäurespiegel ≥ 6,5 mg
/dl) Hyperurikämie Ursachen: ~90% primär ~10% sekundär Harnssäureausscheidung↓ - Genetische Prädisposition (in Kombination mit anderen Faktoren)
- Chronische Nierenerkrankung
(CKD) mit gestörter Nierenfunktion - Medikamente, z.B. Diuretika
, Metformin - Fasten
- (Exzessiver) Alkoholkonsum
Harnsäureproduktion↑ - Lesch-Nyhan-Syndrom (= X-chromosomal rezessive Mutation der Hypoxanthin-Guanin-Phosphoryltransferase (HGPRT) mit konsekutivem Enzymmangel)
- Starker, schneller, erhöhter Zelluntergang z.B. bei Tumorlysesyndrom
(insbesondere infolge von Chemotherapie oder Radiatio bei Leukämie) - Erhöhter Zell-Turnover, z.B. myeloproliferative Erkrankungen, Malignome, Akromegalie
- Hämolyse
- Gykogenose Typ 1 (= Morbus von Giercke)
- Einnahme stark purinhaltige Nahrungsmittel (z.B. Fleisch, Innereien, Alkohol wie Bier und Spirituosen)
- Hohe Einnahme von Zuckerersatzstoffen (z.B. Fructose, Xylit, Sorbit)
Merke
Alkohol kann sowohl zu einer erhöhten Harnsäureproduktion (u.a. aufgrund von häufig hohem Puringehalt) als
auch zu einer gestörten Harnsäureausscheidung (u.a. durch den Abbau zu Laktat → Lactatazidose, bei exzessivem Konsum erhöhte Produktion von Ketonkörpern → Ketoazidose, Dehydratation, toxische Nierenschädigung) führen. Pathophysiologie
Allgemein bei Hyperurikämie: erhöhte Harnsäureproduktion und/oder verringerte Harnsäureausscheidung → Harnsäurekonzentration im Urin oder Blut
übersteigt deren Löslichkeitsgrenze → Ausfällung der Harnsäure mit Natrium als Urat (= Salz der Harnsäure ) → Bildung von Uratkristallen (= Natrium -Harnsäurekristallen) u.a. auch in den Nieren - Akute Uratnephropathie: schneller, starker Anstieg des Harnsäurespiegels > 20. mg
/dl (z.B. bei Tumorlyse -Syndrom) → akute intratubulären Ausfällung von Uratkristallen in großen Mengen → akute Verstopfung der Tubuli- oder Ureterlumina → akuten Nierenschädigung (AKI) - Chronische Uratnephropathie (= Gichtnephropathie): chronische Hyperurikämie (Harnsäurespiegel ≥ 6,5 mg
/dl) insbesondere im Rahmen einer chronischen Gicht → Ausfällung von Uratkristallen im Nierenparenchym (eher selten intratubulär!) → chronische interstitielle Nephritis → selten Progredienz zur chronischen Nierenerkrankung (CKD)
AchtungDer bedeutendster Risikofaktor für die Progredienz einer chronischen Uratnephropathie zur chronischen Nierenerkrankung ist eine begleitende arterielle Hypertonie
!
InfoExkurs: Physiologie der Harnsäure
und Harnsäureausscheidung Harnsäure
entsteht durch Oxidation und Dehydrogenierung aus Xanthin, welches ein Abbauprodukt insbesondere der RNA- und DNA-Purinbasen Adenin und Guanin ist. Die Ausscheidung der Harnsäure
erfolgt zu circa 75% renal. Hierbei wird die Harnsäure frei glomerulär filtriert und circa 90% der Harnsäure im proximalen Tubulus u.a. über den URAT1 (= Urat-Transporter 1) und den OAT1/OAT3 (= organische Anionentransporter 1 und 3) wieder rückresorbiert. Dies stellt sicher, dass der Körper Harnsäure in physiologisch sinnvollen Mengen behält, da Harnsäure antioxidative Eigenschaften besitzt und eine potenzielle Schutzfunktion vor freien Radikalen hat. Ein weiterer Anteil der Harnsäure
wird über spezifische Transporter wie ABCG2 (= ATP -binding cassette sub-family G member 2) und NPT1 (= Natriumphosphat-Cotransporter Typ 1) aktiv tubulär sezerniert. Die Prozesse der glomerulären Filtration, tubulären Rückresorption und Sekretion stehen in einem dynamischen Gleichgewicht, das durch verschiedene Faktoren beeinflusst wird.
Folgend werden die Harnsäureausscheidung beeinflussende beispielhafte Faktoren dargestellt:
Hemmung der Harnsäureausscheidung Förderung der Harnsäureausscheidung Saurer Urin (pH↓→ Löslichkeit der Harnsäure
↓), z.B.:
- Fasten → Ketoazidose
- Metformin, Alkoholexzess → Laktatazidose
Basischer Urin (pH↑→ Löslichkeit der Harnsäure
↑)
- Harnalkalisierung z.B. mit Alkalizitraten
Medikamente, z.B.:
- Diuretika
z.B. Thiaziddiuretika - Metformin → Lakatazidose
Medikamente, z.B.:
- SGLT2-Inhibitoren
InfoExkurs: Wechselwirkungen am URAT1-Transporter (proximaler Tubulus)
Hemmung der Harnsäure
-Rückresorption:
- Laktatazidose oder Ketoazidose: kompetitive Hemmung der Harnsäure
-Rückresorption durch Konkurrenz von Laktat bzw. Ketonkörpern um die Transportkapazitäten der URAT1-Transporters - Azidose
allgemein: Hemmung der Aktivität des URAT1-Transporters bei niedrigem pH-Wert Förderung der Harnsäure
-Rückresorption:
- SGLT2-Inhibitoren: Senkung der tubulären Glucoserückresorption → Steigerung des intratubulären osmotischen Drucks → indirekte Hemmung des URAT1-Transporters → Förderung der Harnsäureausscheidung
Wechselwirkungen am OAT1/OAT3-Transporter (proximaler Tubulus)
Hemmung der Harnsäure
-Rückresorption:
- Thiaziddiuretika
: kompetitive Hemmung der Harnsäure -Rückresorption durch die Konkurrenz um die Transportkapazitäten am OAT1/OAT3-Transporter Weitere Medikamente: einige nicht-steroidale Antirheumatika
(NSAR ) und Antibiotika können ebenfalls die Funktion der OAT-Transporter beeinflussen und somit die Harnsäureausscheidung modulieren.
Pathologie
- Makroskopische Merkmale:
- Oft vergrößerte Nieren
- Ggf. sichtbare Harnsäurekristalle in Form von gelblichen oder orangefarbenen Ablagerungen
- Mikroskopische Merkmale:
- Harnsäurekristalle in den proximalen Tubuli und interstitiell
- Interstitielle Fibrose und Entzündungsinfiltrat (v.a. Lymphozyten und Plasmazellen)
- Ggf. Tubulusschäden
Klinik
- Akute Uratnephropathie: akute Nierenschädigung
(AKI; → siehe Artikel akute Nierenschädigung ) - Chronische Uratnephropathie:
- Ggf. Symptome durch begleitende Urolithiasis
mit Harnsäuresteinen: Flankenschmerzen und Hämaturie - Ggf. Symptome der chronischen Gicht:
- Rezidivierende Gichtanfälle mit symptomfreien Intervallen: sehr schmerzhafte, häufig nächtlich beginnende, maximal 24 Std anhaltende Monoarthritis, insbesondere des Großzehengrundgelenks (= Podagra)
- Gichttophi (= Uratablagerungen in Knochen und/oder Weichteilen)
- In fortgeschrittenen Fällen: Symptome einer chronischen Nierenerkrankung (CKD) bis hin zum terminalen Nierenversagen (→ siehe Artikel chronische Nierenerkrankung
)
- Ggf. Symptome durch begleitende Urolithiasis
Diagnostik
- Anamnese: frühere Gichtanfälle oder Urolithiasis
durch Harnsäuresteine, bekannte Hyperurikämie - Klinische Untersuchung: bei chronischer Gicht ggf. Monoarthritis-Zeichen oder Nachweis von Gichttophi
- Labor:
- Akute Uratnephropathie (insbesondere bei Tumorlyse
-Syndrom): - Massiv erhöhte Harnsäurespiegel (> 20 mg
/dl) - Elektrolytverschiebungen: z.B. Azidose
, Hypokalzämie, Hyperkaliämie , Hyperphosphatämie
- Massiv erhöhte Harnsäurespiegel (> 20 mg
- Chronische Uratnephropathie:
- Hyperurikämie (Harnsäurespiegel ≥ 6,5 mg
/dl) - Albuminurie
- Hyperurikämie (Harnsäurespiegel ≥ 6,5 mg
- Beide Formen: Nierenretentionsparameter↑, Harnsäurekristalle im Urinsediment
- Akute Uratnephropathie (insbesondere bei Tumorlyse
- Sonografie der Nieren
: ggf. vergrößerte Nieren, Nachweis echoreicher Ablagerungen - Nierenbiopsie
: selten erforderlich, nur bei unklaren Befunden
TippTumore, als
potenzielle Ursache der Hyperurikämie, sollten diagnostisch ausgeschlossen werden!
Therapie
- Behandlung der Hyperurikämie: Urikostatika
, v.a. Allopurinol (=Xanthinoxidase-Hemmer), Ultima ratio: Dialyse - Prophylaxe der Ausfällung von Uratkristallen allgemein sowie Therapie (=Chemolitholyse) und/oder Prophylaxe der Urolithiasis
: - Ausreichende Flüssigkeitseinnahme zur Förderung der Harnproduktion (mindestens 2–3 Liter/Tag)
- Harnalkalisierung mittels Alkalizitraten (z.B. Natriumbicarbonat (NaHCO3) oder Kaliumnatriumhydrogenzitrat)
TippBei Risikopatienten, wie beispielsweise solchen mit großer Tumorlast oder vorbestehender Nierenfunktionsstörung, sollte eine prophylaktische Hydratation sowie die Gabe von Allopurinol und Alkalizitraten vor
Beginn einer Chemotherapie erfolgen, um ein Tumorlyse -Syndrom zu vermeiden.
Nephrokalzinose
DefintionDie Nephrokalzinose oder
hyperkalzämische Nephropathie ist eine chronische interstitielle Nephritis, die durch die Ablagerung von Kalziumsalzen (z.B. Kalziumphosphat, Kalziumoxalat) im interstitiellen Nierenparenchym und den distalen Tubuli infolge einer chronischen Hyperkalzämie und/oder Hyperkalzurie entsteht.
Epidemiologie
- Selten
Ursache
- Insbesondere primärer Hyperparathyreoidismus (pHPT; → ursächlich für circa 80% der ambulanten Hyperkalzämien
) - Tumorinduziert
- Paraneoplastische Hyperkalzämie
(durch die Bildung von Parathormon -related Peptides (PTHrP): insbesondere bei kleinzelligem Bronchialkarzinom , Nierenzellkarzinom , Ovarialkarzinom - Osteolytische Tumoren: insbesondere Plasmozytom, Knochenmetastasen (v.a. bei Lungen-, Mamma-, Nierenzell-, Prostatakarzinom
)
- Paraneoplastische Hyperkalzämie
- Weitere Ursachen:
- granulomatöse Erkrankungen wie Sarkoidose oder Tuberkulose (erhöhte Vitamin D3
Aktivierung durch aktivierte Makrophagen der Granulome) - Vitamin-D
-Intoxikation - Medikamentennebenwirkung bei z.B. Thiaziddiuretika
oder Lithium - primäre oder sekundäre Oxalose
- granulomatöse Erkrankungen wie Sarkoidose oder Tuberkulose (erhöhte Vitamin D3
Pathophysiologie
Hyperkalzämie
Pathologie
- Makroskopische Merkmale:
- Diffuse Verkalkungen insbesondere in der Nierenrinde
und im Nierenmark (v.a. Markpyramiden)
- Diffuse Verkalkungen insbesondere in der Nierenrinde
- Mikroskopische Merkmale:
- Frühstadium: diffuse intrazelluläre Kalziumablagerungen in Mitochondrien
und Lysosomen - Spätstadium: diffuse Kalziumablagerungen in der Basalmembran der Tubuli und interstitiell, Tubulusnekrosen- und atrophien, interstitielle Fibrose
- Frühstadium: diffuse intrazelluläre Kalziumablagerungen in Mitochondrien
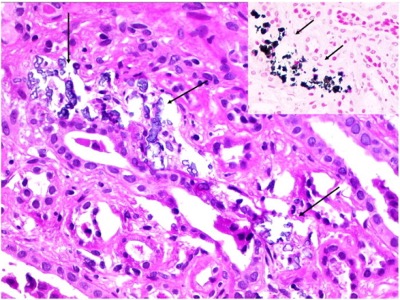
Figure out Fritschi BC, Trachsler J, Varga Z, Binet I, Fehr T. Iatrogenic nephrocalcinosis with acute renal failure: an underestimated complication after parathyroidectomy? NDT Plus. 2010 Dec;3(6):551-4. doi: 10.1093/ndtplus/sfq144. Epub 2010 Jul 27. PMID: 25949465; PMCID: PMC4421429.
Klinik
- Meist asymptomatisch
- Ggf. Symptome der Hyperkalzämie
: z.B. Übelkeit, Erbrechen, Verwirrtheit, Lethargie, Muskelschwäche, Arrhythmien - Ggf. Symptome durch begleitende Urolithiasis
mit kalziumhaltigen Harnsteinen (v.a. Kalziumoxalatsteine): Flankenschmerzen und Hämaturie - Ggf. Diabetes insipidus
renalis: Polyurie , Polydipisie - In fortgeschrittenen Fällen: Symptome einer chronischen Nierenerkrankung (CKD
) bis hin zum terminalen Nierenversagen (→ siehe Artikel chronische Nierenerkrankung )
Diagnostik
- Anamnese und klinische Untersuchung: oft unauffällig, ggf. Symptome der Hyperkalzämie
, ggf. bekannte assoziierte Vorerkrankung (z.B. pHPT, Tumorerkrankungen, Sarkoidose) - Labor:
- Serum
: - Nierenretentionsparameter↑
- Hyperkalzämie
(= Gesamtkalzium >2,65 mmol/L bzw. ionisiertes Kalzium >1,35 mmol/L), - Elektrolytverluste: Hyponatriämie
, Hypokaliämie , Hypophosphatämie
- Urin: oft unauffällig, ggf. Hyperkalzurie und/oder Mikro-/Makrohämaturie
- Serum
- Sonografie der Nieren
: sichtbare, echoreiche Kalkablagerungen mit Schallschatten - Nierenbiopsie
: selten erforderlich, nur bei unklaren Befunden
TippParenchymverkalkungen treten differentialdiagnostisch auch bei der Analgetika-Nephropathie, der Markschwammniere
oder bei renal-tubulärer Azidose (RTA) auf.
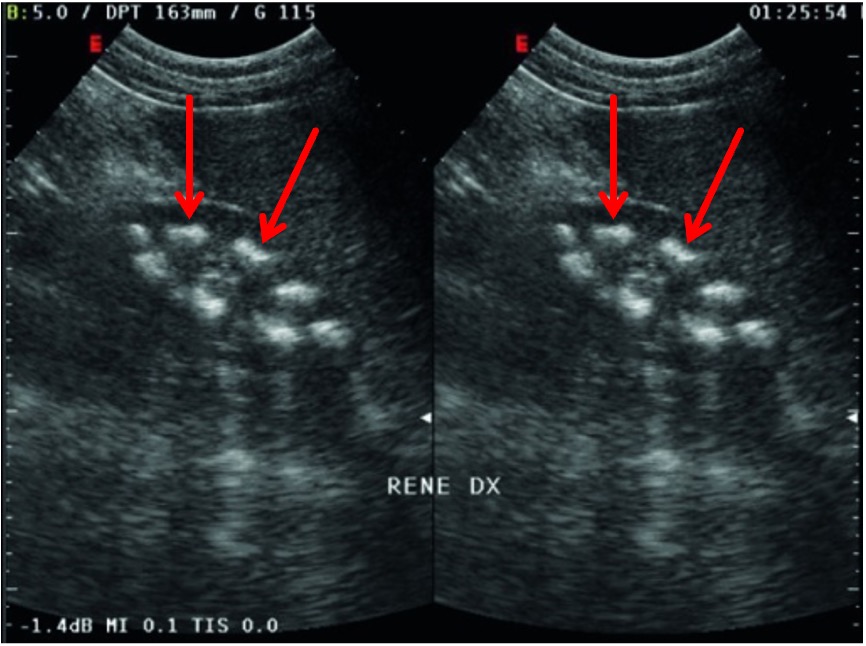
Figure out Di Stefano V, Lionetti E, Rotolo N, La Rosa M, Leonardi S. Hypercalciuria and nephrocalcinosis as early feature of Wilson disease onset: description of a pediatric case and literature review. Hepat Mon. 2012 Aug;12(8):e6233. doi: 10.5812/hepatmon.6233. Epub 2012 Aug 25. PMID: 23087754; PMCID: PMC3475018.
Therapie
- Behandlung der Hyperkalzämie
: - Förderung der Kalzium
-Elimination: Volumengabe mittels 0,9%-ige NaCl-Lösung, dann forcierte Diurese mit Furosemid , ultima ratio: Dialyse - Reduktion der Kalziumzufuhr: kalziumarme Ernährung, ggf. Glukokortikoide
- Hemmung der Osteoklastenbildung und -aktivität: z.B. Bisphosphonate
- Elektrolytausgleich
- Ggf. Prophylaxe der Urolithiasis
: Harnalkalisierung mittels Alkalizitraten, z.B. Natriumbicarbonat (NaHCO3) oder Kaliumnatriumhydrogenzitrat bei Kalziumoxalatsteinen - Behandlung der Grunderkrankung: z.B. Resektion der Nebenschilddrüsen bei primärem Hyperparathyreoidismus, Tumortherapie
- Förderung der Kalzium
AchtungEine forcierte Diurese sollte immer erst nach Volumengabe erfolgen, da sich die Hyperkalzämie
sonst verschlimmern kann!
Analgetikanephropathie
DefinitionDie Analgetikanephropathie ist eine chronische tubulo-interstitielle Nephritis mit charakteristischen renalen Papillennekrosen infolge einer langjährigen, exzessiven Einnahme von Analgetika-Mischpräparaten oder COX-Hemmern.
Epidemiologie
- Inzidenz abnehmend aufgrund strengerer gesetzlicher Regulierungen für den Verkauf von Analgetika-Mischpräparaten
- Insbesondere Frauen zwischen 40-50 Jahren betroffen
Ursache
- Langjährige, exzessive Einnahme von:
- COX-Hemmern: z.B. ASS
, Ibuprofen - Analgetika-Mischpräparaten: Kombination aus mindestens zwei Analgetika (z.B. ASS
+ Paracetamol ) und Zusatzstoffen wie Coffein, Codein oder Barbituraten - Paracetamol
: v.a. bei chronischer Überdosierung
- COX-Hemmern: z.B. ASS
Pathophysiologie
Cyclooxygenase (COX)-Hemmung → verminderte Synthese des vasodilatativ wirkenden Prostaglandins E2 → chronische Minderperfusion der Nieren und Akkumulation schädigender Metabolite wie Paracetamol
Pathologie
- Makroskopische Merkmale:
- Narbig verkleinerte Nieren mit unregelmäßiger, höckriger Oberfläche
- Narbig eingezogene Rinde über den betroffenen Markpyramiden
- Papillenkalzifikationen (= sichtbare Verkalkungen im Bereich der Papillen)
- Mikroskopische Merkmale:
- Pathognomonische Papillennekrosen
- Fortschreitende tubulo-interstitielle Fibrose und Tubulusatrophie
- Infiltration von Makrophagen
und Lymphozyten
Klinik
- Meist lange asymptomatisch, Diagnose häufig als
Zufallsbefund - Spätsymptome bei manifester chronischer Nierenerkrankung (sehr selten):
- Grau-bräunliches Hautkolorit durch kutane Ablagerung von Analgetika-Metaboliten
- Kolikartige Flankenschmerzen und Hämaturie durch Abgang von Papillennekrosen
- Gastrointestinale Beschwerden
- Zeichen einer renalen Anämie
bei CKD
Diagnostik
- Anamnese:
- Chronische Analgetikaeinnahme, insbesondere bei Patient:innen mit chronischen Schmerzen (z.B. Kopfschmerzen
, Arthrose) - Hinweise auf Analgetikaabusus (z.B. Analgetika-Kopfschmerz
)
- Chronische Analgetikaeinnahme, insbesondere bei Patient:innen mit chronischen Schmerzen (z.B. Kopfschmerzen
- Labor:
- Serum
: Nierenretentionsparameter↑, ggf. Hyponatriämie und Hypokaliämie - Urin: sterile Leukozyturie
, gering ausgeprägte tubuläre Proteinurie und Mikrohämaturie
- Serum
- Sonografie der Nieren
: verkleinerte Nieren mit unregelmäßiger, höckriger Oberfläche, ggf. Nachweis von Papillenkalzifikationen - Nierenbiopsie
: selten erforderlich; Nachweis von Papillennekrosen und interstitieller Fibrose
MerkePapillennekrosen sind pathognomonisch für die Analgetika-Nephropathie.
Therapie
- Absetzen nephrotoxischer Analgetika: konsequent und dauerhaft!
- Alternativ: Einsatz von nicht-nephrotoxischen Analgetika unter ärztlicher Kontrolle
- Symptomatische Therapie und Behandlung der Komplikationen
InfoBei einem Serum
-Kreatininwert < 3 mg /dl und konsequenter Analgetikakarenz ist eine Erholung der Nieren möglich.
AchtungCirca 1% der Patient:innen entwickeln eine chronische Nierenerkrankung
, insbesondere bei einem Serum -Kreatininwert von >3 mg /dl.
TippBei Patient:innen mit chronischer Analgetikaeinnahme sollte die Nierenfunktion regelmäßig kontrolliert werden, um eine frühe Diagnose zu ermöglichen.
Quellen
- KDIGO-Leitlinien
- S3-Leitlinie Nationale VersorgungsLeitlinie (NVL) Typ-2-Diabetes, NVL-Programm von BÄK, KBV, AWMF
- KDIGO 2022 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease (CKD)
- S3-Leitlinie Nationale VersorgungsLeitlinie Hypertonie, NVL-Programm von BÄK, KBV, AWMF
- KDIGO 2021 Clinical Practice Guideline on the Management of Blood Pressure (BP) in Chronic Kidney Disease (CKD)
- S2k-Leitlinie Erkrankungen der Nierenarterie, Deutsche Gesellschaft für Gefäßchirurgie und Gefäßmedizin - Gesellschaft für operative, endovaskuläre und präventive Gefäßmedizin e.V. (DGG)
- S3-Leitlinie Diagnostik, Therapie und Nachsorge für Patienten mit monoklonaler Gammopathie unklarer Signifikanz (MGUS) oder Multiplem Myelom, Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO)
- S3-Leitlinie Diagnostik und Therapie der ANCA-assoziierten Vaskulitiden, Deutsche Gesellschaft für Rheumatologie und Klinische Immunologie e.V. (DGRh)
- S2k-Leitlinie Management der Großgefäßvaskulitiden, Deutsche Gesellschaft für Rheumatologie und Klinische Immunologie e.V. (DGRh)
- KDIGO 2024 Clinical Practice Guideline for the Management of Lupus Nephritis
- S3-Leitlinie Diagnostik und Therapie der Gicht, Deutsche Gesellschaft für Rheumatologie und Klinische Immunologie e.V. (DGRh)
- S1-Leitlinie Primärer Hyperparathyreoidismus, Deutsche Gesellschaft für pädiatrische und adoleszente Endokrinologie und Diabetologie (DGPAED)
- S2k-Leitlinie Rationelle Labordiagnostik zur Abklärung Akuter Nierenschädigungen und Progredienter Nierenerkrankungen, Deutsche Gesellschaft für Klinische Chemie und Laboratoriumsmedizin e.V. (DGKL), Deutsche Gesellschaft für Nephrologie e.V. (DGfN)



